Page 46 - Instrumen Soal HOTS
P. 46
i. ii.
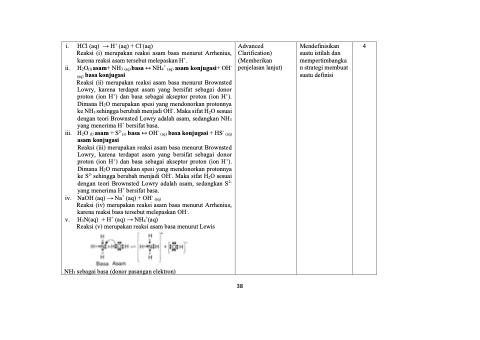
HCl (aq) → H+ (aq) + Cl-(aq)
Reaksi (i) merupakan reaksi asam basa menurut Arrhenius,
karena reaksi asam tersebut melepaskan H+.
H2O(l) asam+ NH3 (aq) basa ↔ NH4+ (aq) asam konjugasi+ OH- (aq) basa konjugasi
Reaksi (ii) merupakan reaksi asam basa menurut Brownsted Lowry, karena terdapat asam yang bersifat sebagai donor proton (ion H+) dan basa sebagai akseptor proton (ion H+). Dimana H2O merupakan spesi yang mendonorkan protonnya ke NH3 sehingga berubah menjadi OH-. Maka sifat H2O sesuai dengan teori Brownsted Lowry adalah asam, sedangkan NH3 yang menerima H+ bersifat basa.
H2O (l) asam + S2-(s) basa ↔ OH- (aq) basa konjugasi + HS- (aq) asam konjugasi
Reaksi (iii) merupakan reaksi asam basa menurut Brownsted Lowry, karena terdapat asam yang bersifat sebagai donor proton (ion H+) dan basa sebagai akseptor proton (ion H+). Dimana H2O merupakan spesi yang mendonorkan protonnya ke S2- sehingga berubah menjadi OH-. Maka sifat H2O sesuai dengan teori Brownsted Lowry adalah asam, sedangkan S2- yang menerima H+ bersifat basa.
NaOH (aq) → Na+ (aq) + OH- (aq)
Reaksi (iv) merupakan reaksi asam basa menurut Arrhenius,
karena reaksi basa tersebut melepaskan OH-. H3N(aq) + H+ (aq) → NH4+(aq)
Reaksi (v) merupakan reaksi asam basa menurut Lewis
iii.
iv. v.
NH3 sebagai basa (donor pasangan elektron)
Advanced Clarification) (Memberikan penjelasan lanjut)
Mendefinisikan suatu istilah dan mempertimbangka n strategi membuat suatu definisi
38
4