Page 69 - Instrumen Soal HOTS
P. 69
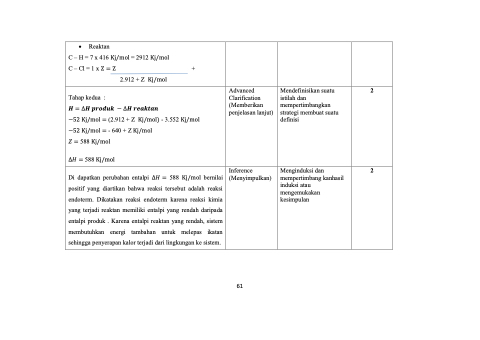
• Reaktan
C – H = 7 x 416 Kj/mol = 2912 Kj/mol C – Cl = 1 x Z = Z
2.912 + Z Kj/mol
+
Tahap kedua :
𝑯 = ∆𝑯 𝒑𝒓𝒐𝒅𝒖𝒌 − ∆𝑯 𝒓𝒆𝒂𝒌𝒕𝒂𝒏
−52 Kj/mol = (2.912 + Z Kj/mol) - 3.552 Kj/mol −52 Kj/mol = - 640 + Z Kj/mol
𝑍 = 588 Kj/mol
∆𝐻 = 588 Kj/mol
Advanced Clarification (Memberikan penjelasan lanjut)
Mendefinisikan suatu istilah dan mempertimbangkan strategi membuat suatu definisi
2
Di dapatkan perubahan entalpi ∆𝐻 = 588 Kj/mol bernilai positif yang diartikan bahwa reaksi tersebut adalah reaksi endoterm. Dikatakan reaksi endoterm karena reaksi kimia yang terjadi reaktan memiliki entalpi yang rendah daripada entalpi produk . Karena entalpi reaktan yang rendah, sistem membutuhkan energi tambahan untuk melepas ikatan sehingga penyerapan kalor terjadi dari lingkungan ke sistem.
Inference (Menyimpulkan)
Menginduksi dan mempertimbang kanhasil induksi atau mengemukakan kesimpulan
2
61