Page 33 - Demo
P. 33
La formule permettant de calculer le volume d’excès en fonction de la fraction molaire de l’éthanol est la suivante :
𝑉𝑟 /23è!
Avec
= ((𝑀é%1)'"# − 𝑀/)$) − 𝜌,é#)'./ (𝑉°é%1)'"# − 𝑉°/)$)) × 𝑋é%1)'"# − 𝜌,é#)'./ × 𝑉°/)$ + 𝑀/)$ 𝜌,é#)'./
Méthanol : Masse molaire l’éthanol en g/mol
Meau : Masse molaire de l’eau en g/mol
𝜌,é#)'./: Masse volumique du mélange en g/cm3
V°eau : volume réduit de l’eau (cm3) lorsque la fraction molaire de l’éthanol est nulle. V°éthanol : volume réduit de l’éthanol (cm3) lorsque la fraction molaire de l’eau est nulle. Xéthanol : fraction molaire de l’éthanol.
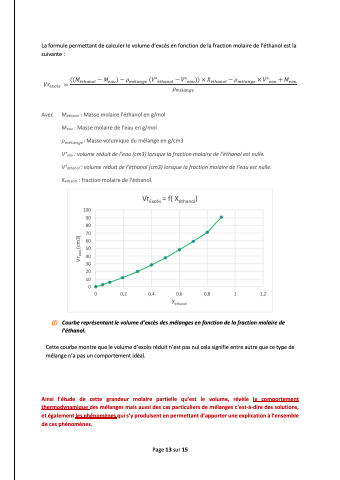
(f)
Courbe représentant le volume d’excès des mélanges en fonction de la fraction molaire de l’éthanol.
100
90
80
70
60
50
40
30
20
10
0
VrExcès = f( Xéthanol)
0 0,2 0,4 0,6 0,8 1 1,2 Xéthanol
Cette courbe montre que le volume d’excès réduit n’est pas nul cela signifie entre autre que ce type de mélange n’a pas un comportement idéal.
Ainsi l’étude de cette grandeur molaire partielle qu’est le volume, révèle le comportement thermodynamique des mélanges mais aussi des cas particuliers de mélanges c’est-à-dire des solutions, et également les phénomènes qui s’y produisent en permettant d’apporter une explication à l’ensemble de ces phénomènes.
Page 13 sur 15
Vrexès (cm3)