Page 26 - E-Modul laju reaksi revisi_Neat
P. 26
E-Modul Berbasis Inquiri Terbimbing
12
PERTEMUAN 2
TEORI TUMBUKAN
Alokasi Waktu : 2 X 45 Menit
3.6.2 menjelaskan teori tumbukan pada reaksi kimia
ORIENTASI
MATERI PRASYARAT :
Menurut teori tumbukan, reaksi kimia terjadi karena adanya partikel-partikel
yang saling bertumbukan. Semakin banyak terjadi tumbukan, maka reaksi akan
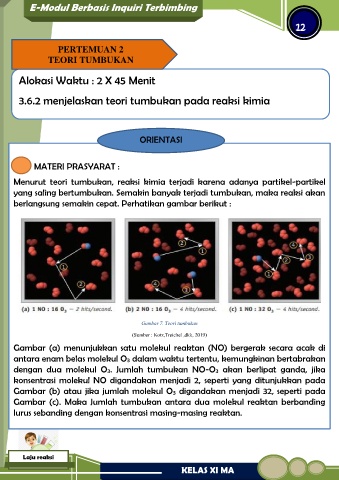
berlangsung semakin cepat. Perhatikan gambar berikut :
Gambar 7. Teori tumbukan
(Sumber : Kotz,Treichel ,dkk, 2019)
Gambar (a) menunjukkan satu molekul reaktan (NO) bergerak secara acak di
antara enam belas molekul O3 dalam waktu tertentu, kemungkinan bertabrakan
dengan dua molekul O3. Jumlah tumbukan NO-O3 akan berlipat ganda, jika
konsentrasi molekul NO digandakan menjadi 2, seperti yang ditunjukkan pada
Gambar (b) atau jika jumlah molekul O3 digandakan menjadi 32, seperti pada
Gambar (c). Maka Jumlah tumbukan antara dua molekul reaktan berbanding
lurus sebanding dengan konsentrasi masing-masing reaktan.
Laju reaksi
zz KELAS XI MA