Page 22 - Buku Elektronik Kesetimbangan Kimia
P. 22
Buku Kimia SMA IX Berkonteks Lingkungan
dinamis sampai mencapai kesetimbangan. Dengan kata lain, reaksi
berlangsung secara dinamis dan terjadi kesetimbangan dinamis, yaitu reaksi berlangsung
cara terus-menerus tanpa berhenti, dengan konsentrasi zat terus berubah tergantung arah reaksi.
Reaksi ini berakhir dengan suatu kesetimbangan atau menuju keadaan setimbang, yaitu
jika tidak terjadi lagi perubahan makroskopis, yang dapat dilihat dari warna zat tidak menjadi
cokelat tua atau cokelat muda, konsentrasinya pun menjadi tetap. Pada keadaan setimbang tidak
terjadi perubahan konsentrasi walaupun secara mikroskopis reaksi tetap berlangsung.
Perhatikan grafik perubahan konsentrasi gas N2O4 dan gas NO2 dengan waktu dan grafik
laju reaksi dngan waktu pada Gambar 2.3!
Berdasarkan contoh reaksi kesetimbangan tersebut, dapat disimpulkan bahwa pada reaksi
kesetimbangan terjadi sebagai berikut.
a. Pada suatu saat, jumlah larutan atau konsentrasi larutan tidak berubah lagi, perbandingan
konsentrasi konstan
b. Reaksi berlangsung dalam dua arah, ke kanan dan ke kiri, yang berlangsung terus-
menerus, sampai pada kondisi laju reaksi ke kanan sama dengan laju reaksi ke kiri walau
jumlah dan hasil reaksi tidak sama.
c. Baik reaktan maupun produk tidak keluar dari sistem.
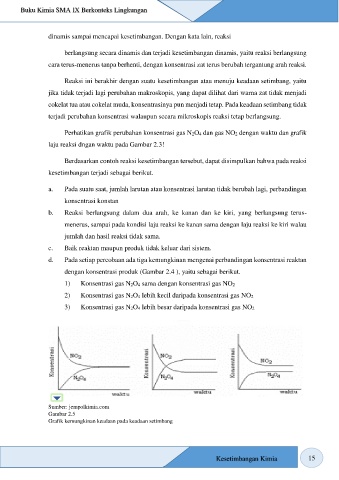
d. Pada setiap percobaan ada tiga kemungkinan mengenai perbandingan konsentrasi reaktan
dengan konsentrasi produk (Gambar 2.4 ), yaitu sebagai berikut.
1) Konsentrasi gas N2O4 sama dengan konsentrasi gas NO2
2) Konsentrasi gas N2O4 lebih kecil daripada konsentrasi gas NO2
3) Konsentrasi gas N2O4 lebih besar daripada konsentrasi gas NO2
Sumber: jempolkimia.com
Gambar 2.5
Grafik kemungkinan keadaan pada keadaan setimbang
Kesetimbangan Kimia 15