Page 44 - Kelarutan dan hasil kali kelarutan
P. 44
E-Modul
5E Instruction Model
Explanation
Ksp menyatakan kelarutan dari senyawa ion atau garam yang sukar
larut. Nilai Ksp dapat ditentukan melalui percobaan di laboratorium
dengan cara mengukur kelarutan zat hingga larutan tepat jenuh.
Terdapat hubungan antara konstanta hasil kali kelarutan (Ksp) dan
kelarutan (s). Kelarutan (s) senyawa sukar larut dapat dinyatakan
dalam konsentrasi mol/L atau Molar (M) sementara untuk senyawa
mudah larut biasanya dinyatakan dalam g/L.
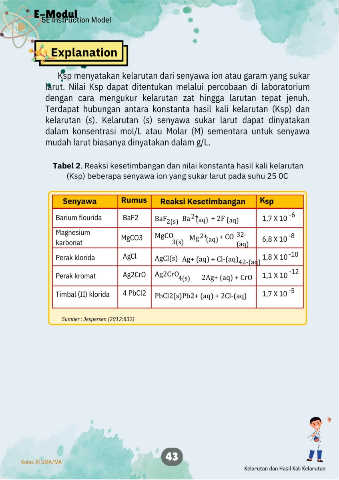
Tabel 2. Reaksi kesetimbangan dan nilai konstanta hasil kali kelarutan
(Ksp) beberapa senyawa ion yang sukar larut pada suhu 25 0C
Senyawa Rumus Reaksi Kesetimbangan Ksp
2+
Barium flourida BaF2 BaF 2(s) Ba (aq) + 2F - (aq) 1,7 X 10 -6
Magnesium MgCO 2+ + CO 32- -8
karbonat MgCO3 3(s) Mg (aq) (aq) 6,8 X 10
Perak klorida AgCl AgCl(s) Ag+ (aq) + Cl-(aq) 42-(aq) 1,8 X 10 -10
Perak kromat Ag2CrO Ag2CrO 4(s) 2Ag+ (aq) + CrO 1,1 X 10 -12
Timbal (II) klorida 4 PbCl2 PbCl2(s) Pb2+ (aq) + 2Cl-(aq) 1,7 X 10 -5
Sumber : Jespersen (2012:832)
43
Kelas XI SMA/MA
Kelarutan dan Hasil Kali Kelarutan