Page 10 - E-MODUL ASAM BASA KD 3.8
P. 10
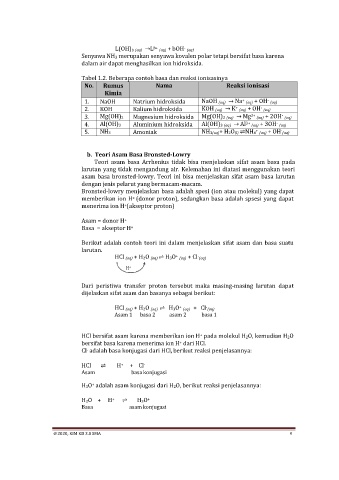
L(OH)b (aq) →L b+ (aq) + bOH (aq)
-
Senyawa NH3 merupakan senyawa kovalen polar tetapi bersifat basa karena
dalam air dapat menghasilkan ion hidroksida.
Tabel 1.2. Beberapa contoh basa dan reaksi ionisasinya
No. Rumus Nama Reaksi ionisasi
Kimia
-
+
1. NaOH Natrium hidroksida NaOH (aq) → Na (aq) + OH (aq)
2. KOH Kalium hidroksida KOH (aq) → K (aq) + OH (aq)
-
+
3. Mg(OH)2 Magnesium hidroksida Mg(OH)2 (aq) → Mg 2+ (aq) + 2OH (aq)
-
4. Al(OH)3 Aluminium hidroksida Al(OH)3 (aq) → Al 3+ (aq) + 3OH (aq)
-
5. NH3 Amoniak NH3(aq)+ H2O(l) ⇌NH4 (aq) + OH (aq)
+
-
b. Teori Asam Basa Bronsted-Lowry
Teori asam basa Arrhenius tidak bisa menjelaskan sifat asam basa pada
larutan yang tidak mengandung air. Kelemahan ini diatasi menggunakan teori
asam basa bronsted-lowry. Teori ini bisa menjelaskan sifat asam basa larutan
dengan jenis pelarut yang bermacam-macam.
Bronsted-lowry menjelaskan basa adalah spesi (ion atau molekul) yang dapat
memberikan ion H (donor proton), sedangkan basa adalah spsesi yang dapat
+
menerima ion H (akseptor proton)
+
Asam = donor H +
+
Basa = akseptor H
Berikut adalah contoh teori ini dalam menjelaskan sifat asam dan basa suatu
larutan.
+
-
HCl (aq) + H2O (aq) ⇌ H3O (aq) + Cl (aq)
Dari peristiwa transfer proton tersebut maka masing-masing larutan dapat
dijelaskan sifat asam dan basanya sebagai berikut:
+ -
HCl (aq) + H2O (aq) ⇌ H3O (aq) + Cl (aq)
Asam 1 basa 2 asam 2 basa 1
HCl bersifat asam karena memberikan ion H pada molekul H2O, kemudian H2O
+
bersifat basa karena menerima ion H dari HCl.
+
Cl adalah basa konjugasi dari HCl, berikut reaksi penjelasannya:
-
HCl ⇌ H + + Cl
-
Asam basa konjugasi
+
H3O adalah asam konjugasi dari H2O, berikut reaksi penjelasannya:
H2O + H + ⇌ H3O
+
Basa asam konjugasi
@2020, KIM KD 3.8 SMA 9