Page 17 - Kesetimbangan Ion dan pH Larutan Garam
P. 17
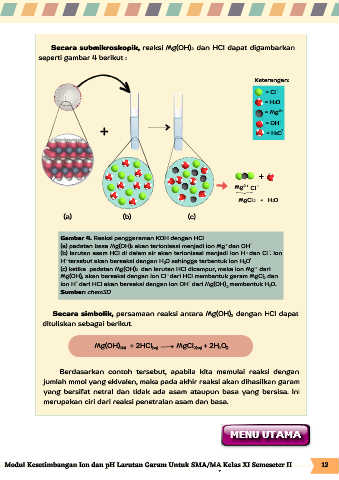
Secara submikroskopik, reaksi Mg(OH) dan HCl dapat digambarkan
2
seperti gambar 4 berikut :
Keterangan:
= Cl -
= H O
2
= Mg 2+
+ = OH - +
= H O
3
+
Mg 2 + Cl -
MgCl2 + H O
2
(a) (b) (c)
Gambar 4. Reaksi penggaraman KOH dengan HCl
-
+
(a) padatan basa Mg(OH) akan terionisasi menjadi ion Mg dan OH
2
-
+
(b) larutan asam HCl di dalam air akan terionisasi menjadi ion H dan Cl . Ion
+
+
H tersebut akan bereaksi dengan H O sehingga terbentuk ion H O
2
3
+
(c) ketika padatan Mg(OH) dan larutan HCl dicampur, maka ion Mg dari
2
-
Mg(OH) akan bereaksi dengan ion Cl dari HCl membentuk garam MgCl dan
2
2
+ -
ion H dari HCl akan bereaksi dengan ion OH dari Mg(OH) membentuk H O.
2
2
Sumber: chem3D
Secara simbolik, persamaan reaksi antara Mg(OH) dengan HCl dapat
2
dituliskan sebagai berikut.
Mg(OH) + 2HCl MgCl + 2H O
2
2(aq)
2 (s)
(aq)
(l)
Berdasarkan contoh tersebut, apabila kita memulai reaksi dengan
jumlah mmol yang ekivalen, maka pada akhir reaksi akan dihasilkan garam
yang bersifat netral dan tidak ada asam ataupun basa yang bersisa. Ini
merupakan ciri dari reaksi penetralan asam dan basa.
Modul Kesetimbangan Ion dan pH Larutan Garam Untuk SMA/MA Kelas XI Semeseter II 12
+