Page 14 - Kesetimbangan Kimia
P. 14
Keadaan setimbang dan kesetimbangan dinamis
,
Setelah reaksi berlangsung selama beberapa waktu konsentrasi N H , dan NH
2
3
2
adalah tetap. Pada kondisi ini reaksi mencapai keadaan setimbang. Mengapa hal ini bisa
terjadi ? Hal ini terjadi karena laju reaksi pembentukan NH dari gas N dan H sama
2
3
2
cepat dengan laju reaksi peruraian gas NH menjadi gas N dan H . Dengan kata lain,
2
2
3
pada waktu kesetimbangan terjadi laju reaksi maju (forward reaction) sama dengan laju
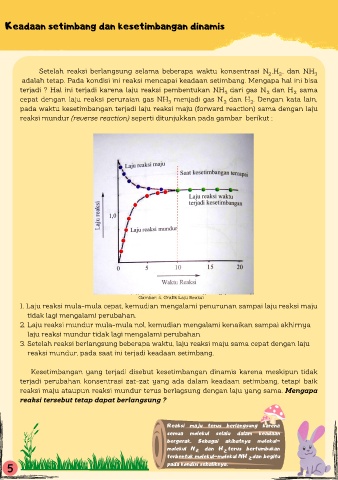
reaksi mundur (reverse reaction) seperti ditunjukkan pada gambar berikut :
Gambar. 4. Grafik Laju Reaksi
1. Laju reaksi mula-mula cepat, kemudian mengalami penurunan sampai laju reaksi maju
tidak lagi mengalami perubahan.
2. Laju reaksi mundur mula-mula nol, kemudian mengalami kenaikan sampai akhirnya
laju reaksi mundur tidak lagi mengalami perubahan
3. Setelah reaksi berlangsung beberapa waktu, laju reaksi maju sama cepat dengan laju
reaksi mundur, pada saat ini terjadi keadaan setimbang.
Kesetimbangan yang terjadi disebut kesetimbangan dinamis karena meskipun tidak
terjadi perubahan konsentrasi zat-zat yang ada dalam keadaan setimbang, tetapi baik
reaksi maju ataupun reaksi mundur terus berlagsung dengan laju yang sama. Mengapa
reaksi tersebut tetap dapat berlangsung ?
Reaksi maju terus berlangsung karena
semua molekul selalu dalam keadaan
bergerak. Sebagai akibatnya molekul-
molekul N dan H terus bertumbukan
2
2
terbentuk molekul-molekul NH dan begitu
2
5 pada kondisi sebaliknya.