Page 254 - BAHAN AJAR KAPITA SELEKTA KIMIA BERBASIS CASE METHOD DAN PROJECT
P. 254
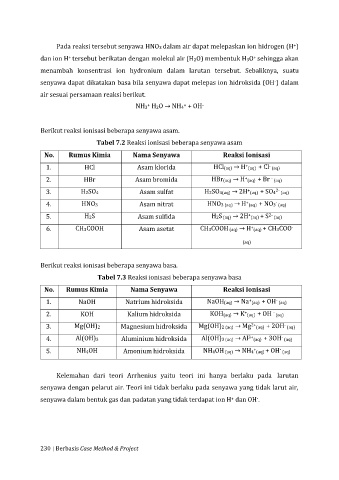
Pada reaksi tersebut senyawa HNO3 dalam air dapat melepaskan ion hidrogen (H )
+
dan ion H tersebut berikatan dengan molekul air (H2O) membentuk H3O sehingga akan
+
+
menambah konsentrasi ion hydronium dalam larutan tersebut. Sebaliknya, suatu
senyawa dapat dikatakan basa bila senyawa dapat melepas ion hidroksida (OH ) dalam
-
air sesuai persamaan reaksi berikut.
+
+
-
NH3 H2O → NH4 + OH
Berikut reaksi ionisasi beberapa senyawa asam.
Tabel 7.2 Reaksi ionisasi beberapa senyawa asam
No. Rumus Kimia Nama Senyawa Reaksi Ionisasi
+
1. HCl Asam klorida HCl(aq) → H (aq) + Cl (aq)
-
-
+
2. HBr Asam bromida HBr(aq) → H (aq) + Br (aq)
+
3. H2SO4 Asam sulfat H2SO4(aq) → 2H (aq) + SO4 2- (aq)
-
+
4. HNO3 Asam nitrat HNO3 (aq) → H (aq) + NO3 (aq)
+
5. H2S Asam sulfida H2S (aq) → 2H (aq) + S 2- (aq)
6. CH3COOH Asam asetat CH3COOH (aq) → H (aq) + CH3COO -
+
(aq)
Berikut reaksi ionisasi beberapa senyawa basa.
Tabel 7.3 Reaksi ionisasi beberapa senyawa basa
No. Rumus Kimia Nama Senyawa Reaksi Ionisasi
1. NaOH Natrium hidroksida NaOH(aq) → Na (aq) + OH (aq)
+
-
+
2. KOH Kalium hidroksida KOH(aq) → K (aq) + OH (aq)
-
-
3. Mg(OH)2 Magnesium hidroksida Mg(OH)2 (aq) → Mg 2+ (aq) + 2OH (aq)
-
4. Al(OH)3 Aluminium hidroksida Al(OH)3 (aq) → Al 3+ (aq) + 3OH (aq)
-
+
5. NH4OH Amonium hidroksida NH4OH (aq) → NH4 (aq) + OH (aq)
Kelemahan dari teori Arrhenius yaitu teori ini hanya berlaku pada larutan
senyawa dengan pelarut air. Teori ini tidak berlaku pada senyawa yang tidak larut air,
senyawa dalam bentuk gas dan padatan yang tidak terdapat ion H dan OH .
+
-
230 | Berbasis Case Method & Project