Page 14 - CHUYÊN ĐỀ: PHẢN ỨNG OXI HOÁ – KHỬ
P. 14
0,059 [MnO−][H+]8
E = 1,51 + lg 4 ([H+] = 1)
5 [Mn2+]
Ở điểm tương đương thế của 2 cặp bằng nhau, nên thế là thế chung cho 2 cặp và phản
ứng đạt trạng thái căn bằng: E=0,77+ 0,059lg[Fe3+]
5E = 5.1,51 + 0,059lg[MnO−][H+]8 [Mn2+]
1 [Fe2+] 4
4
6E = 0,77 + 5.1,51 + 0,059lg[Fe3+][MnO−][H+]8 (*)
[Fe2+ ][Mn2+ ]
Vì ở điểm tương đương, lượng ion MnO4- được đưa vào dung dịch tương ứng chính
xác với phản ứng:
5Fe2+ + MnO4- + 8H+ ⎯⎯→ 5Fe3+ + Mn2+ + 4H2O
Vì vậy [Fe2+ ] = 5[MnO4-] và [Fe3+ ] = 5[Mn2+] nên:
[Fe3+]= 5[Mn2+] [Fe2+ ] 5[MnO− ]
4
[Fe3+ ][MnO− ]
4 = 1 và [H+] = 1 theo giả thiết
Và do đó:
[Fe2+ ][Mn2+ ]
Thay các giá trị này vào (*) ta được
6E = 0,77 + 5.1,51 => E = 1,39V
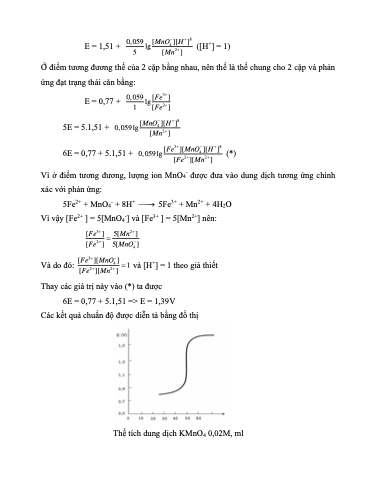
Các kết quả chuẩn độ được diễn tả bằng đồ thị
Thể tích dung dịch KMnO4 0,02M, ml