Page 26 - E-BOOKLET ASAM BASA BERBASIS PBL _Neat
P. 26
Booklet Asam Basa Model PBL
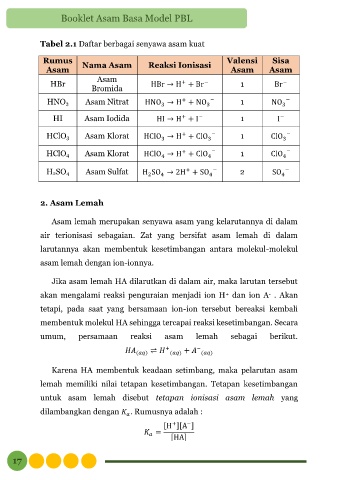
Tabel 2.1 Daftar berbagai senyawa asam kuat
Rumus Nama Asam Reaksi Ionisasi Valensi Sisa
Asam Asam Asam
Asam
HBr HBr → H + Br 1 Br
−
+
−
Bromida
−
HNO3 Asam Nitrat HNO → H + NO 3 − 1 NO
+
3
3
−
−
HI Asam Iodida HI → H + I 1 I
+
HClO3 Asam Klorat HClO → H + ClO 3 − 1 ClO 3 −
+
3
HClO4 Asam Klorat HClO → H + ClO 4 − 1 ClO 4 −
+
4
+
H2SO4 Asam Sulfat H SO → 2H + SO 4 − 2 SO 4 −
2
4
2. Asam Lemah
Asam lemah merupakan senyawa asam yang kelarutannya di dalam
air terionisasi sebagaian. Zat yang bersifat asam lemah di dalam
larutannya akan membentuk kesetimbangan antara molekul-molekul
asam lemah dengan ion-ionnya.
Jika asam lemah HA dilarutkan di dalam air, maka larutan tersebut
akan mengalami reaksi penguraian menjadi ion H dan ion A . Akan
-
+
tetapi, pada saat yang bersamaan ion-ion tersebut bereaksi kembali
membentuk molekul HA sehingga tercapai reaksi kesetimbangan. Secara
umum, persamaan reaksi asam lemah sebagai berikut.
( ) ⇌ + ( ) + − ( )
Karena HA membentuk keadaan setimbang, maka pelarutan asam
lemah memiliki nilai tetapan kesetimbangan. Tetapan kesetimbangan
untuk asam lemah disebut tetapan ionisasi asam lemah yang
dilambangkan dengan . Rumusnya adalah :
+
−
[H ][A ]
= [HA]
17