Page 38 - ชุดที่ 4 เซลล์ไฟฟ้าเคมี (เซลล์กัลวานิก)
P. 38
ชุดกิจกรรมการเรียนรู้ วิชาเคมี เรื่อง ไฟฟ้าเคมี ชุดที่ 4 เซลล์ไฟฟ้าเคมี (เซลล์กัลวานิก)
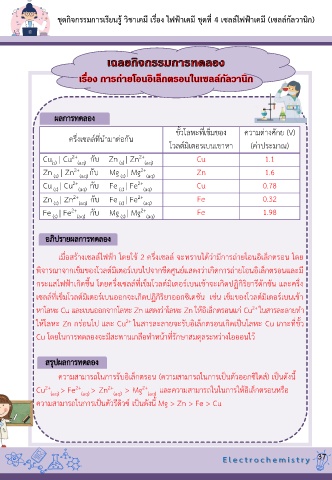
ขั้วโลหะที่เข็มของ ความต่างศักย (V)
ครึ่งเซลล์ที่น ามาต่อกัน
โวลต์มิเตอรเบนเขาหา (ค่าประมาณ)
Cu | Cu 2+ (aq) กับ Zn | Zn 2+ (aq) Cu 1.1
(s)
(s)
Zn | Zn 2+ (aq) กับ Mg | Mg 2+ (aq) Zn 1.6
(s)
(s)
Cu | Cu 2+ (aq) กับ Fe | Fe 2+ (aq) Cu 0.78
(s)
(s)
Zn | Zn 2+ (aq) กับ Fe | Fe 2+ (aq) Fe 0.32
(s)
(s)
Fe | Fe 2+ (aq) กับ Mg | Mg 2+ (aq) Fe 1.98
(s)
(s)
เมื่อสร้างเซลล์ไฟฟ้า โดยใช้ 2 ครึ่งเซลล์ จะทราบได้ว่ามีการถ่ายโอนอิเล็กตรอน โดย
พิจารณาจากเข็มของโวลต์มิเตอร์เบนไปจากขีดศูนย์แสดงว่าเกิดการถ่ายโอนอิเล็กตรอนและมี
กระแสไฟฟ้าเกิดขึ้น โดยครึ่งเซลล์ทเข็มโวลต์มิเตอร์เบนเข้าจะเกิดปฏิกิริยารีดักชัน และครึ่ง
ี่
ี่
เซลล์ทเข็มโวลต์มิเตอร์เบนออกจะเกิดปฏิกิริยาออกซิเดชัน เช่น เข็มของโวลต์มิเตอร์เบนเข้า
2+
หาโลหะ Cu และเบนออกจากโลหะ Zn แสดงว่าโลหะ Zn ให้อิเล็กตรอนแก่ Cu ในสารละลายทา
ี่
ให้โลหะ Zn กร่อนไป และ Cu ในสารละลายจะรับอิเล็กตรอนเกิดเป็นโลหะ Cu เกาะทขั้ว
2+
Cu โดยในการทดลองจะมีสะพานเกลือท าหน้าที่รักษาสมดุลระหว่างไอออนไว้
ความสามารถในการรับอิเล็กตรอน (ความสามารถในการเป็นตัวออกซิไดส์) เป็นดังนี้
Cu 2+ (aq) > Fe 2+ (aq) > Zn 2+ (aq) > Mg 2+ (aq) และความสามารถในในการให้อิเล็กตรอนหรือ
ความสามารถในการเป็นตัวรีดิวซ์ เป็นดังนี้ Mg > Zn > Fe > Cu
E l e c t r o c h e m i s t r y 37