Page 15 - E-MODUL IKATAN KIMIA_Neat
P. 15
IKATAN KIMIA 1
Pada umumnya unsur-unsur pada tabel periodik tidak stabil. Untuk
mencapai kesetabilannya, unsur-unsur tersebut harus berikatan. Pada tabel
periodik unsur terdapat satu golongan yang unsur-unsurnya stabil atau tidak
reaktif yaitu gas mulia. Gas mulia terletak pada golongan VIIIA, mempunyai
dua elektron pada kulit terluar untuk He dan delapan elektron untuk kulit terluar
Ne, Ar, Kr, Xe, Rn.
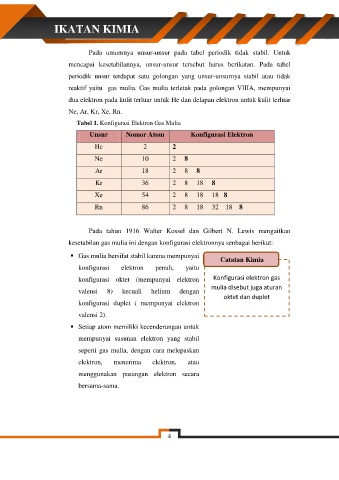
Tabel 1. Konfigurasi Elektron Gas Mulia
Unsur Nomor Atom Konfigurasi Elektron
He 2 2
Ne 10 2 8
Ar 18 2 8 8
Kr 36 2 8 18 8
Xe 54 2 8 18 18 8
Rn 86 2 8 18 32 18 8
Pada tahun 1916 Walter Kossel dan Gilbert N. Lewis mengaitkan
kesetabilan gas mulia ini dengan konfigurasi elektronnya senbagai berikut:
Gas mulia bersifat stabil karena mempunyai Catatan Kimia
konfigurasi elektron penuh, yaitu
konfigurasi oktet (mempunyai elektron Konfigurasi elektron gas
valensi 8) kecuali helium dengan mulia disebut juga aturan
oktet dan duplet
konfigurasi duplet ( mempunyai elektron
valensi 2).
Setiap atom memiliki kecenderungan untuk
mempunyai susunan elektron yang stabil
seperti gas mulia, dengan cara melepaskan
elektron, menerima elektron, atau
menggunakan pasangan elektron secara
bersama-sama.
4