Page 50 - E-MODUL SIFAT ASAM BASA SENYAWA ORGANIK_ANDRA MEISANTRY ASSARI_(F1062181002)
P. 50
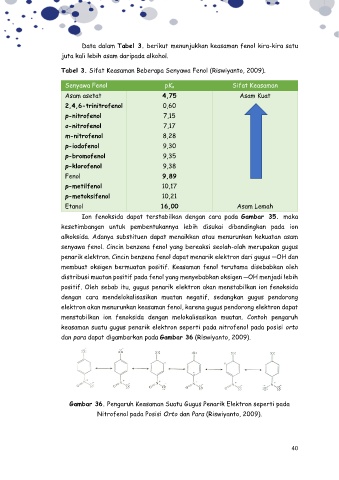
Data dalam Tabel 3. berikut menunjukkan keasaman fenol kira-kira satu
juta kali lebih asam daripada alkohol.
Tabel 3. Sifat Keasaman Beberapa Senyawa Fenol (Riswiyanto, 2009).
Senyawa Fenol pKa Sifat Keasaman
Asam asetat 4,75 Asam Kuat
2,4,6-trinitrofenol 0,60
p-nitrofenol 7,15
o-nitrofenol 7,17
m-nitrofenol 8,28
p-iodofenol 9,30
p-bromofenol 9,35
p-klorofenol 9,38
Fenol 9,89
p-metilfenol 10,17
p-metoksifenol 10,21
Etanol 16,00 Asam Lemah
Ion fenoksida dapat terstabilkan dengan cara pada Gambar 35. maka
kesetimbangan untuk pembentukannya lebih disukai dibandingkan pada ion
alkoksida. Adanya substituen dapat menaikkan atau menurunkan kekuatan asam
senyawa fenol. Cincin benzena fenol yang bereaksi seolah-olah merupakan gugus
penarik elektron. Cincin benzena fenol dapat menarik elektron dari gugus ─OH dan
membuat oksigen bermuatan positif. Keasaman fenol terutama disebabkan oleh
distribusi muatan positif pada fenol yang menyebabkan oksigen ─OH menjadi lebih
positif. Oleh sebab itu, gugus penarik elektron akan menstabilkan ion fenoksida
dengan cara mendelokalisasikan muatan negatif, sedangkan gugus pendorong
elektron akan menurunkan keasaman fenol, karena gugus pendorong elektron dapat
menstabilkan ion fenoksida dengan melokalisasikan muatan. Contoh pengaruh
keasaman suatu gugus penarik elektron seperti pada nitrofenol pada posisi orto
dan para dapat digambarkan pada Gambar 36 (Riswiyanto, 2009).
Gambar 36. Pengaruh Keasaman Suatu Gugus Penarik Elektron seperti pada
Nitrofenol pada Posisi Orto dan Para (Riswiyanto, 2009).
40