Page 11 - Modul ikatan kimia CEP
P. 11
1. Kestabilan Unsur-unsur
Unsur-unsur dialam umumnya tidak stabil sehingga ditemukan dalam bentuk
senyawanya. Atom-atom unsur tersebut saling berikatan membentuk molekul unsur
atau molekul senyawa, untuk mencapai keadaan yang lebih stabil. Gas mulia merupakan
unsur golongan VIII A dan bersifat inert. Hal ini karena gas mulia sulit bereaksi dengan
atom unsur lainnya. Di alam, gas mulia berada sebagai atom tunggal. Atom-atom gas
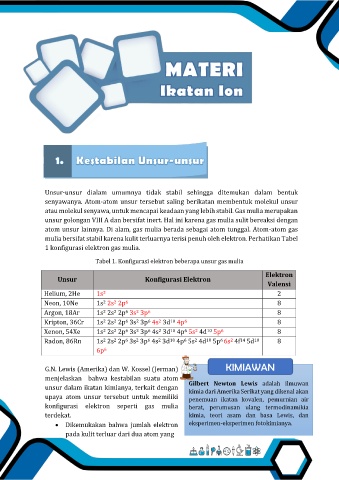
mulia bersifat stabil karena kulit terluarnya terisi penuh oleh elektron. Perhatikan Tabel
1 konfigurasi elektron gas mulia.
Tabel 1. Konfigurasi elektron beberapa unsur gas mulia
Elektron
Unsur Konfigurasi Elektron
Valensi
Helium, 2He 1s 2
2
Neon, 10Ne 1s 2s 2p 8
2
2
6
Argon, 18Ar 1s 2s 2p 3s 3p 8
6
2
2
6
2
Kripton, 36Cr 1s 2s 2p 3s 3p 4s 3d 4p 8
6
2
6
2
6
10
2
2
Xenon, 54Xe 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 8
6
6
2
10
2
2
2
6
10
2
6
Radon, 86Rn 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 8
14
10
10
2
10
2
6
6
6
2
2
2
6
2
6p
6
G.N. Lewis (Amerika) dan W. Kossel (Jerman) KIMIAWAN
menjelaskan bahwa kestabilan suatu atom
unsur dalam ikatan kimianya, terkait dengan Gilbert Newton Lewis adalah ilmuwan
kimia dari Amerika Serikat yang dikenal akan
upaya atom unsur tersebut untuk memiliki penemuan ikatan kovalen, pemurnian air
konfigurasi elektron seperti gas mulia berat, perumusan ulang termodinamikia
terdekat. kimia, teori asam dan basa Lewis, dan
• Dikemukakan bahwa jumlah elektron eksperimen-eksperimen fotokimianya.
pada kulit terluar dari dua atom yang