Page 39 - E-modul Interaktif Bentuk Molekul
P. 39
Fase 2
Penemuan Konsep
Hibridisasi adalah istilah yang diterapkan pada pencampuran orbital atom dalam suatu
atom (biasanya atom pusat) ke menghasilkan satu set orbital hibrid.
Langkah – Langkah Menentukan Hibridisasi Pada Suatu Senyawa:
1. Menentukan konfigurasi elektron suatu senyawa
2. Menentukan atom pusat
3. Membuat diagram orbital atom pusat
4. Memastikan adanya elektron yang tidak berpasangan
5. Membuat diagram orbital suatu senyawa pada keadaan dasar
6. Membuat diagram orbital suatu senyawa pada keadaan tereksitasi
7. Membuat diagram orbital suatu senyawa pada keadaan hibridisasi
8. Menentukan hibridisasi dan geometri molekul suatu senyawa
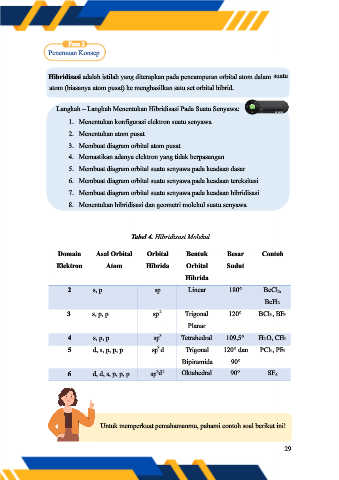
Tabel 4. Hibridisasi Molekul
Domain Asal Orbital Orbital Bentuk Besar Contoh
Elektron Atom Hibrida Orbital Sudut
Hibrida
2 s, p sp Linear 180° BeCl2,
BeH2
2
3 s, p, p sp Trigonal 120° BCl3, BF3
Planar
3
4 s, p, p sp Tetrahedral 109,5° H2O, CH4
3
5 d, s, p, p, p sp d Trigonal 120° dan PCl5, PF5
Bipiramida 90°
3 2
6 d, d, s, p, p, p sp d Oktahedral 90° SF6
Untuk memperkuat pemahamanmu, pahami contoh soal berikut ini!
29