Page 8 - Nur saidah_2108076035
P. 8
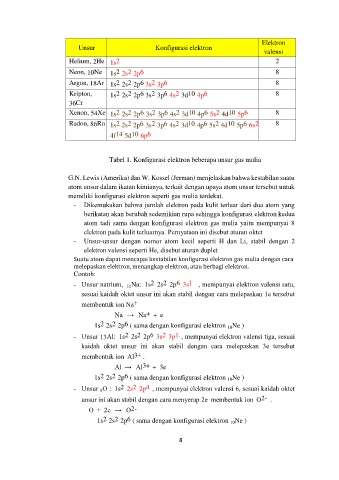
Elektron
Unsur Konfigurasi elektron
valensi
2
Helium, 2He 1s 2
6
2 2
Neon, 10Ne 1s 2s 2p 8
2 2
6
6 2
Argon, 18Ar 1s 2s 2p 3s 3p 8
6 2
6 2
6
Kripton, 1s 2s 2p 3s 3p 4s 3d 10 4p 8
2 2
36Cr
2 2
6 2
6 2
6
6 2
Xenon, 54Xe 1s 2s 2p 3s 3p 4s 3d 10 4p 5s 4d 10 5p 8
6 2
Radon, 86Rn 1s 2s 2p 3s 3p 4s 3d 10 4p 5s 4d 10 5p 6s 8
2 2
6 2
6 2
6 2
6
4f 14 5d 10 6p
Tabel 1. Konfigurasi elektron beberapa unsur gas mulia
G.N. Lewis (Amerika) dan W. Kossel (Jerman) menjelaskan bahwa kestabilan suatu
atom unsur dalam ikatan kimianya, terkait dengan upaya atom unsur tersebut untuk
memiliki konfigurasi elektron seperti gas mulia terdekat.
- Dikemukakan bahwa jumlah elektron pada kulit terluar dari dua atom yang
berikatan akan berubah sedemikian rupa sehingga konfigurasi elektron kedua
atom tadi sama dengan konfigurasi elektron gas mulia yaitu mempunyai 8
elektron pada kulit terluarnya. Pernyataan ini disebut aturan oktet
- Unsur-unsur dengan nomor atom kecil seperti H dan Li, stabil dengan 2
elektron valensi seperti He, disebut aturan duplet
Suatu atom dapat mencapai kestabilan konfigurasi elektron gas mulia dengan cara
melepaskan elektron, menangkap elektron, atau berbagi elektron.
Contoh:
6
2
2
- Unsur natrium, 11 Na: 1s 2s 2p 3s 1 , mempunyai elektron valensi satu,
sesuai kaidah oktet unsur ini akan stabil dengan cara melepaskan 1e tersebut
+
membentuk ion Na
Na → Na + + e
6
2 2
1s 2s 2p ( sama dengan konfigurasi elektron 10 Ne )
1.
2
6
2
2
- Unsur 13Al: 1s 2s 2p 3s 3p , mempunyai elektron valensi tiga, sesuai
kaidah oktet unsur ini akan stabil dengan cara melepaskan 3e tersebut
membentuk ion Al 3+ .
Al → Al 3+ + 3e
2 2
6
1s 2s 2p ( sama dengan konfigurasi elektron 10 Ne )
4
2
2
- Unsur 8 O : 1s 2s 2p , mempunyai elektron valensi 6, sesuai kaidah oktet
unsur ini akan stabil dengan cara menyerap 2e membentuk ion O 2- .
2-
O + 2e → O
2 2
6
1s 2s 2p ( sama dengan konfigurasi elektron 10 Ne )
8