Page 37 - E-BOOK STOIKIOMETRI
P. 37
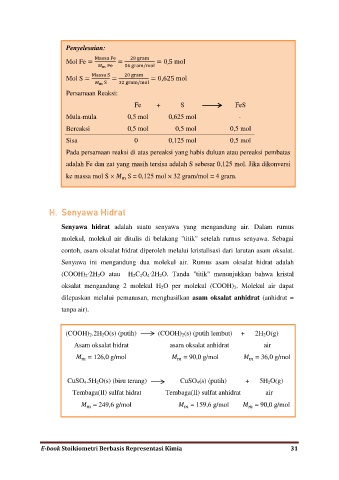
Penyelesaian:
M ss F 8 g
Mol Fe = = = 0,5 mol
m F 56 g /
M ss g
Mol S = m = 3 g / = 0,625 mol
Persamaan Reaksi:
Fe + S FeS
Mula-mula 0,5 mol 0,625 mol -
Bereaksi 0,5 mol 0,5 mol 0,5 mol
Sisa 0 0,125 mol 0,5 mol
Pada persamaan reaksi di atas pereaksi yang habis duluan atau pereaksi pembatas
adalah Fe dan zat yang masih tersisa adalah S sebesar 0,125 mol. Jika dikonversi
ke massa mol S × S = 0,125 mol × 32 gram/mol = 4 gram.
H. Senyawa Hidrat
Senyawa hidrat adalah suatu senyawa yang mengandung air. Dalam rumus
molekul, molekul air ditulis di belakang "titik" setelah rurnus senyawa. Sebagai
contoh, asam oksalat hidrat diperoleh melalui kristalisasi dari larutan asam oksalat.
Senyawa ini mengandung dua molekul air. Rumus asam oksalat hidrat adalah
(COOH) 2∙2H 2O atau H 2C 2O 4∙2H 2O. Tanda "titik" menunjukkan bahwa kristal
oksalat mengandung 2 molekul H 2O per molekul (COOH) 2. Molekul air dapat
dilepaskan melalui pemanasan, menghasilkan asam oksalat anhidrat (anhidrat =
tanpa air).
(COOH) 2.2H 2O(s) (putih) (COOH) 2(s) (putih lembut) + 2H 2O(g)
Asam oksalat hidrat asam oksalat anhidrat air
= 126,0 g/mol = 90,0 g/mol = 36,0 g/mol
CuSO 4.5H 2O(s) (biru terang) CuSO 4(s) (putih) + 5H 2O(g)
Tembaga(II) sulfat hidrat Tembaga(II) sulfat anhidrat air
= 249,6 g/mol = 159,6 g/mol = 90,0 g/mol
E-book Stoikiometri Berbasis Representasi Kimia 31