Page 126 - KIMIA SMA KELAS XI BERBASIS PjBl
P. 126
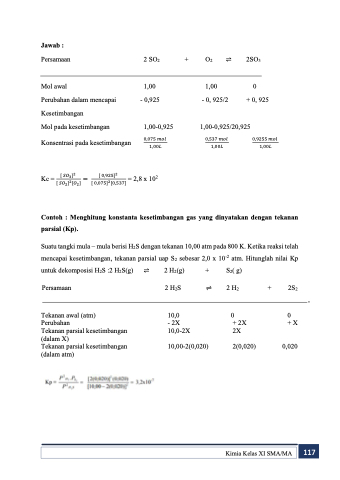
Jawab :
Persamaan
Mol awal
Perubahan dalam mencapai Kesetimbangan
Mol pada kesetimbangan
Konsentrasi pada kesetimbangan
2 SO2
1,00 - 0,925
1,00-0,925
0,075 𝑚𝑜𝑙 1,00𝐿
+
O2 ⇌ 1,00
2SO3
0
+ 0, 925
0,9255 𝑚𝑜𝑙 1,00𝐿
- 0, 925/2 1,00-0,925/20,925
0,537 𝑚𝑜𝑙 1,00𝐿
Kc = [ 𝑆𝑂3]2 = [ 0,925]2 = 2,8 x 102 [ 𝑆𝑂2]2[𝑂2] [ 0,075]2[0,537]
Contoh : Menghitung konstanta kesetimbangan gas yang dinyatakan dengan tekanan parsial (Kp).
Suatu tangki mula – mula berisi H2S dengan tekanan 10,00 atm pada 800 K. Ketika reaksi telah mencapai kesetimbangan, tekanan parsial uap S2 sebesar 2,0 x 10-2 atm. Hitunglah nilai Kp
untuk dekomposisi H2S :2 H2S(g) Persamaan
Tekanan awal (atm)
Perubahan
Tekanan parsial kesetimbangan (dalam X)
Tekanan parsial kesetimbangan (dalam atm)
⇌
2 H2(g) + 2 H2S ⇌
10,0
- 2X 10,0-2X
10,00-2(0,020)
S2( g) 2 H2
0
+ 2X 2X
2(0,020)
+
2S2
0
+ X
0,020
-
Kimia Kelas XI SMA/MA
117