Page 18 - EMODUL ASAM BASA REVISI
P. 18
E-MODUL ASAM & BASA
Berbasis Guided Discovery Learning
Tabel 2. Beberapa contoh basa, nama basa, dan reaksi ionisasinya.
Rumus basa Nama basa Reaksi ionisasi
NaOH Natrium hidroksida NaOH (aq) → Na + (aq) + OH - (aq)
KOH Kalium hidroksida KOH (aq) → K + (aq) + OH - (aq)
Ca(OH) 2 Kalsium hidroksida Ca(OH) 2(aq) → Ca 2+ (aq) + 2OH - (aq)
Ba(OH) 2 Barium hidroksida Ba(OH) 2(aq) → Ba 2+ (aq) + 2OH - (aq)
NH Amonia NH + H O ⇄ NH + + OH -
3 3(aq) 2 (aq) 4 (aq) (aq)
(Sudarmo, 2017: 191).
Informasi !
Definisi Svante Arrhenius mengenai asam-basa hanya
terbatas pada senyawa yang larut di dalam medium air. Lalu,
bagaimana jika senyawa tersebut tidak larut di dalam medium air?
Disamping itu, tidak semua senyawa basa menurut Arrhenius itu
bersifat basa, sebagai contoh CH COOH dan HCOOH yang
3
merupakan asam. Teori Arrhenius juga tidak dapat menjelaskan
sifat basa dari senyawa amonia (NH ), karena tidak mengandung
3
-
OH . Definisi asam-basa yang dikemukakan oleh Johannes
Bronsted dan Thomas Lowry memperbaiki kelemahan teori asam-
basa Arrhenius.
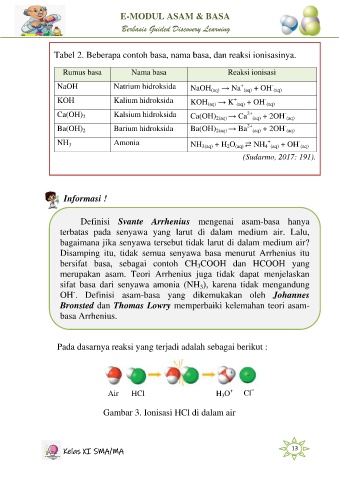
Pada dasarnya reaksi yang terjadi adalah sebagai berikut :
Air HCl H O + Cl −
3
Gambar 3. Ionisasi HCl di dalam air
Kelas XI SMA/MA 13