Page 56 - Modul PBL Struktur Atom -Keunggulan Nanoteknologi
P. 56
untuk melepaskan satu elektron dari atom induk. Energi ionisasi kedua adalah energi yang
diperlukan untuk melepaskan elektron valensi kedua dari ion univalen untuk membentuk ion
divalen, dan seterusnya. Energi ionisasi berturut-turut meningkat. Energi ionisasi kedua selalu
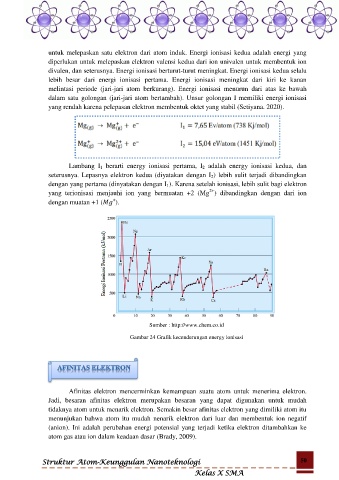
lebih besar dari energi ionisasi pertama. Energi ionisasi meningkat dari kiri ke kanan
melintasi periode (jari-jari atom berkurang). Energi ionisasi menurun dari atas ke bawah
dalam satu golongan (jari-jari atom bertambah). Unsur golongan I memiliki energi ionisasi
yang rendah karena pelepasan elektron membentuk oktet yang stabil (Setiyana. 2020).
Lambang I 1 berarti energy ionisasi pertama, I 2 adalah energy ionisasi kedua, dan
seterusnya. Lepasnya elektron kedua (diyatakan dengan I 2) lebih sulit terjadi dibandingkan
dengan yang pertama (dinyatakan dengan I 1). Karena setelah ionisasi, lebih sulit bagi elektron
2+
yang terionisasi menjauhi ion yang bermuatan +2 (Mg ) dibandingkan dengan dari ion
+
dengan muatan +1 ( ).
Sumber : http://www.chem.co.id
Gambar 24 Grafik kecenderungan energy ionisasi
Afinitas elektron mencerminkan kemampuan suatu atom untuk menerima elektron.
Jadi, besaran afinitas elektron merupakan besaran yang dapat digunakan untuk mudah
tidaknya atom untuk menarik elektron. Semakin besar afinitas elektron yang dimiliki atom itu
menunjukan bahwa atom itu mudah nenarik elektron dari luar dan membentuk ion negatif
(anion). Ini adalah perubahan energi potensial yang terjadi ketika elektron ditambahkan ke
atom gas atau ion dalam keadaan dasar (Brady, 2009).
Struktur Atom-Keunggulan Nanoteknologi 50
Kelas X SMA