Page 24 - Demo
P. 24
La courbe obtenue est représentative d’un cas particulier de mélanges : les solutions.
Ce qui diffère la solution des autres types de mélanges, c’est la proportion dans le lequel se trouve ses constituants : l’un de ses constituant est majoritaire il s’agit du solvant et l’autre est minoritaire il s’agit du soluté.
Pour l’étude réalisée, la soude est le soluté et l’eau est le solvant.
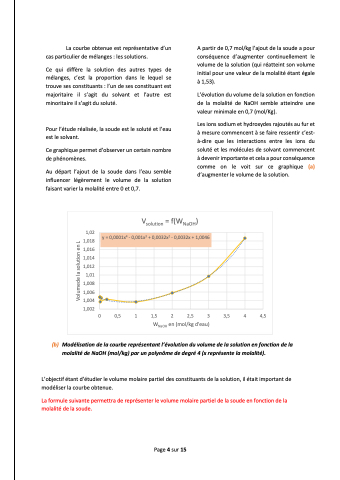
Ce graphique permet d’observer un certain nombre de phénomènes.
Au départ l’ajout de la soude dans l’eau semble influencer légèrement le volume de la solution faisant varier la molalité entre 0 et 0,7.
1,02 1,018 1,016 1,014 1,012
1,01 1,008 1,006 1,004 1,002
Vsolution = f(WNaOH)
(b) Modélisationdelacourbereprésentantl’évolutionduvolumedelasolutionenfonctiondela molalité de NaOH (mol/kg) par un polynôme de degré 4 (x représente la molalité).
L’objectif étant d’étudier le volume molaire partiel des constituants de la solution, il était important de modéliser la courbe obtenue.
La formule suivante permettra de représenter le volume molaire partiel de la soude en fonction de la molalité de la soude.
Page 4 sur 15
A partir de 0,7 mol/kg l’ajout de la soude a pour conséquence d’augmenter continuellement le volume de la solution (qui réatteint son volume initial pour une valeur de la molalité étant égale à 1,53).
L’évolution du volume de la solution en fonction de la molalité de NaOH semble atteindre une valeur minimale en 0,7 (mol/Kg).
Les ions sodium et hydroxydes rajoutés au fur et à mesure commencent à se faire ressentir c’est- à-dire que les interactions entre les ions du soluté et les molécules de solvant commencent à devenir importante et cela a pour conséquence comme on le voit sur ce graphique (a) d’augmenter le volume de la solution.
y = 0,0001x4 - 0,001x3 + 0,0032x2 - 0,0032x + 1,0046
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 WNaOH en (mol/kg d'eau)
Volumede la solution en L