Page 26 - Demo
P. 26
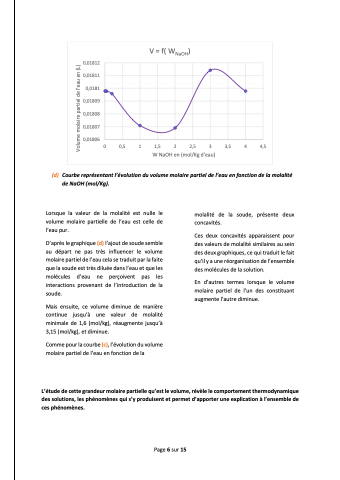
0,01812 0,01811 0,0181 0,01809 0,01808 0,01807 0,01806
V = f( WNaOH)
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 W NaOH en (mol/Kg d'eau)
(d) Courbereprésentantl’évolutionduvolumemolairepartieldel’eauenfonctiondelamolalité de NaOH (mol/Kg).
Lorsque la valeur de la molalité est nulle le volume molaire partielle de l’eau est celle de l’eau pur.
D’après le graphique (d) l’ajout de soude semble au départ ne pas très influencer le volume molaire partiel de l’eau cela se traduit par la faite que la soude est très diluée dans l’eau et que les molécules d’eau ne perçoivent pas les interactions provenant de l’introduction de la soude.
Mais ensuite, ce volume diminue de manière continue jusqu’à une valeur de molalité minimale de 1,6 (mol/kg), réaugmente jusqu’à 3,15 (mol/kg), et diminue.
Comme pour la courbe (c), l’évolution du volume molaire partiel de l’eau en fonction de la
L’étude de cette grandeur molaire partielle qu’est le volume, révèle le comportement thermodynamique des solutions, les phénomènes qui s’y produisent et permet d’apporter une explication à l’ensemble de ces phénomènes.
Page 6 sur 15
molalité de la soude, présente deux concavités.
Ces deux concavités apparaissent pour des valeurs de molalité similaires au sein des deux graphiques, ce qui traduit le fait qu’il y a une réorganisation de l’ensemble des molécules de la solution.
En d’autres termes lorsque le volume molaire partiel de l’un des constituant augmente l’autre diminue.
Volume molaire partiel de l'eau en (L)