Page 15 - Sistem periodik unsur
P. 15
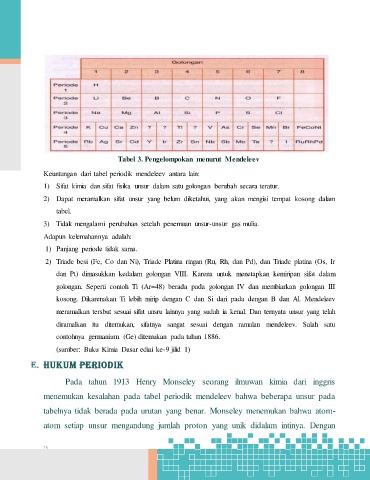
Tabel 3. Pengelompokan menurut Mendeleev
Keuntungan dari tabel periodik mendeleev antara lain:
1) Sifat kimia dan sifat fisika unsur dalam satu golongan berubah secara teratur.
2) Dapat meramalkan sifat unsur yang belum diketahui, yang akan mengisi tempat kosong dalam
tabel.
3) Tidak mengalami perubahan setelah penemuan unsur-unsur gas mulia.
Adapun kelemahannya adalah:
1) Panjang periode tidak sama.
2) Triade besi (Fe, Co dan Ni), Triade Platina ringan (Ru, Rh, dan Pd), dan Triade platina (Os, Ir
dan Pt) dimasukkan kedalam golongan VIII. Karena untuk menetapkan kemiripan sifat dalam
golongan. Seperti contoh Ti (Ar=48) berada pada golongan IV dan membiarkan golongan III
kosong. Dikarenakan Ti lebih mirip dengan C dan Si dari pada dengan B dan Al. Mendeleev
meramalkan tersbut sesuai sifat unsru lainnya yang sudah ia kenal. Dan ternyata unsur yang telah
diramalkan itu ditemukan, sifatnya sangat sesuai dengan ramalan mendeleev. Salah satu
contohnya germanium (Ge) ditemukan pada tahun 1886.
(sumber: Buku Kimia Dasar ediai ke-9 jilid 1)
e. Hukum Periodik
Pada tahun 1913 Henry Monseley seorang ilmuwan kimia dari inggris
menemukan kesalahan pada tabel periodik mendeleev bahwa beberapa unsur pada
tabelnya tidak berada pada urutan yang benar. Monseley menemukan bahwa atom-
atom setiap unsur mengandung jumlah proton yang unik didalam intinya. Dengan
13