Page 15 - Modul Kesetimbangan Ion dan pH Larutan Garam
P. 15
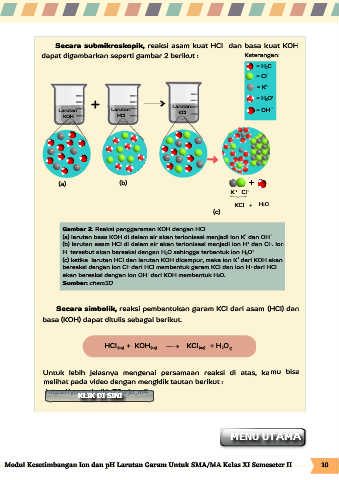
Secara submikroskopik, reaksi asam kuat HCl dan basa kuat KOH
dapat digambarkan seperti gambar 2 berikut : Keterangan:
= H O
2
-
= Cl
+
= K
+
+ Larutan = H O
3
-
Larutan Larutan KCl = OH
KOH HCl
(a) (b) +
-
K + Cl
KCl + H O
2
(c)
Gambar 2. Reaksi penggaraman KOH dengan HCl
+
(a) larutan basa KOH di dalam air akan terionisasi menjadi ion K dan OH -
+
-
(b) larutan asam HCl di dalam air akan terionisasi menjadi ion H dan Cl . Ion
H tersebut akan bereaksi dengan H O sehingga terbentuk ion H O +
+
3
2
+
(c) ketika larutan HCl dan larutan KOH dicampur, maka ion K dari KOH akan
bereaksi dengan ion Cl dari HCl membentuk garam KCl dan ion H dari HCl
+
-
-
akan bereaksi dengan ion OH dari KOH membentuk H O.
2
Sumber: chem3D
Secara simbolik, reaksi pembentukan garam KCl dari asam (HCl) dan
basa (KOH) dapat ditulis sebagai berikut.
HCl + KOH KCl + H O
2
(aq)
(aq)
(aq)
(l)
Untuk lebih jelasnya mengenai persamaan reaksi di atas, kamu bisa
melihat pada video dengan mengklik tautan berikut :
https://youtu.be/NqZ2srjo_m4
Modul Kesetimbangan Ion dan pH Larutan Garam Untuk SMA/MA Kelas XI Semeseter II 10