Page 41 - Ebook Kesetimbangan Kimia
P. 41
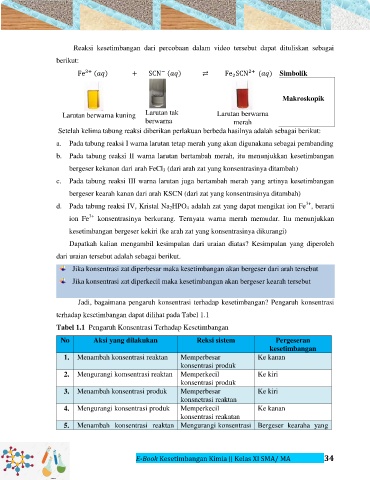
Reaksi kesetimbangan dari percobaan dalam video tersebut dapat dituliskan sebagai
berikut:
( ) ( ) ( ) Simbolik
Makroskopik
Larutan berwarna kuning Larutan tak Larutan berwarna
berwarna merah
Setelah kelima tabung reaksi diberikan perlakuan berbeda hasilnya adalah sebagai berikut:
a. Pada tabung reaksi I warna larutan tetap merah yang akan digunakana sebagai pembanding
b. Pada tabung reaksi II warna larutan bertambah merah, itu menunjukkan kesetimbangan
bergeser kekanan dari arah FeCl 3 (dari arah zat yang konsentrasinya ditambah)
c. Pada tabung reaksi III warna larutan juga bertambah merah yang artinya kesetimbangan
bergeser kearah kanan dari arah KSCN (dari zat yang konsentrasinya ditambah)
3+
d. Pada tabung reaksi IV, Kristal Na 2HPO 4 adalah zat yang dapat mengikat ion Fe , berarti
3+
ion Fe konsentrasinya berkurang. Ternyata warna merah memudar. Itu menunjukkan
kesetimbangan bergeser kekiri (ke arah zat yang konsentrasinya dikurangi)
Dapatkah kalian mengambil kesimpulan dari uraian diatas? Kesimpulan yang diperoleh
dari uraian tersebut adalah sebagai berikut.
Jika konsentrasi zat diperbesar maka kesetimbangan akan bergeser dari arah tersebut
Jika konsentrasi zat diperkecil maka kesetimbangan akan bergeser kearah tersebut
Jadi, bagaimana pengaruh konsentrasi terhadap kesetimbangan? Pengaruh konsentrasi
terhadap kesetimbangan dapat dilihat pada Tabel 1.1
Tabel 1.1 Pengaruh Konsentrasi Terhadap Kesetimbangan
No Aksi yang dilakukan Reksi sistem Pergeseran
kesetimbangan
1. Menambah konsentrasi reaktan Memperbesar Ke kanan
konsentrasi produk
2. Mengurangi komsentrasi reaktan Memperkecil Ke kiri
konsentrasi produk
3. Menambah konsentrasi produk Memperbesar Ke kiri
konsnetrasi reaktan
4. Mengurangi konsentrasi produk Memperkecil Ke kanan
konsentrasi reakatan
5. Menambah konsentrasi reaktan Mengurangi konsentrasi Bergeser kearaha yang
E-Book Kesetimbangan Kimia ∣∣ Kelas XI SMA/ MA 34