Page 166 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 166
Chapitre 6 ■ La détermination des structures
groupe d'atomes susceptibles d'entrer en vibration ou en rotation, suivant une fréquence qui lui est
propre, correspond une bande d'absorption à une longueur d'onde déterminée.
Dans la région usuelle de l'infrarouge (entre 2 et 15 micromètres), on observe principalement des
bandes en rapport avec deux sortes de vibrations (cf.figures incluses dans le tableau 6.1) :
• Vibration d'élongation (ou « de valence ») : oscillations de deux atomes liés, dans l'axe de leur
liaison, produisant une variation périodique de leur distance.
• Vibrations de dformation : oscillations de deux atomes liés à un troisième, produisant une varia-
tion périodique de l'angle des deux liaisons.
À chacun de ces deux modes de vibrations sont associées des bandes d'absorption caractéristiques
de groupements d'atomes particuliers. Le tableau 6.1 donne, à titre d'exemple, les positions de
quelques-unes de ces bandes.
Tous les atomes d'une molécule sont susceptibles de participer à des mouvements de vibration, de
sorte que les spectres dans l'infrarouge sont compliqués et présentent de nombreuses bandes d'absorption
(fig. 6.8); il est rare quel' on puisse assigner chacune des bandes observées à un mode de vibration précis.
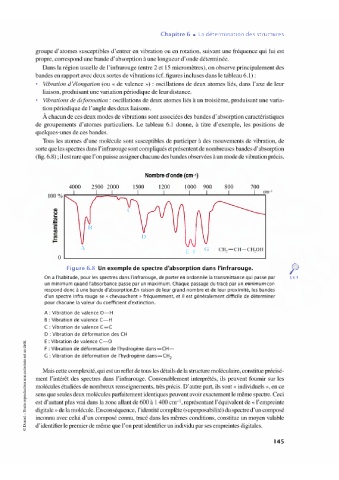
Nombre d'onde (cm-1)
4000 2500 2000 1500 1200 1000 900 800 700
cmI
Q)
€o
r
Cl!
=
±%
0
r
e D
A CH,=CH CH,OH
E F
0
p
Figure 6.8 Un exemple de spectre d'absorption dans l'infrarouge.
On a l'habitude, pour les spectres dans l'infrarouge, de porter en ordonnée la transmittance qui passe par § 6.9
un minimum quand l'absorbance passe par un maximum. Chaque passage du tracé par un minimum cor-
respond donc à une bande d'absorption.En raison de leur grand nombre et de leur proximité, les bandes
d'un spectre infra rouge se «chevauchent» fréquemment, et il est généralement difficile de déterminer
pour chacune la valeur du coefficient d'extinction.
A: Vibration de valence O H
B: Vibration de valence CH
C: Vibration de valence C=C
D : Vibration de déformation des CH
E: Vibration de valence CO
F: Vibration de déformation de l'hydrogène dans=CH
G : Vibration de déformation de l'hydrogène dans=CH,
Mais cette complexité, qui est un reflet de tous les détails de la structure moléculaire, constitue précisé-
ment l'intérêt des spectres dans l'infrarouge. Convenablement interprétés, ils peuvent fournir sur les
molécules étudiées de nombreux renseignements, très précis. D'autre part, ils sont « individuels », en ce
sens que seules deux molécules parfaitement identiques peuvent avoir exactement le même spectre. Ceci
1
est d'autant plus vrai dans la zone allant de 600 à 1 400 cm- , représentant l'équivalent de « l'empreinte
digitale» de la molécule. En conséquence, l'identité complète (superposabilité) du spectre d'un composé
inconnu avec celui d'un composé connu, tracé dans les mêmes conditions, constitue un moyen valable
d'identifier le premier de même quel' on peut identifier un individu par ses empreintes digitales.
145