Page 4 - Victor Arian Toledo
P. 4
QUÍMICA 5TO AÑO SECUNDARIA
5TO AÑO SECUNDARIA
QUÍMICA
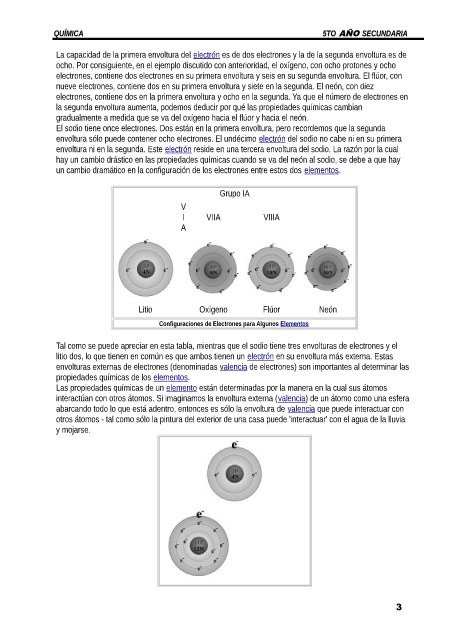
La capacidad de la primera envoltura del electrón es de dos electrones y la de la segunda envoltura es de
ocho. Por consiguiente, en el ejemplo discutido con anterioridad, el oxígeno, con ocho protones y ocho
electrones, contiene dos electrones en su primera envoltura y seis en su segunda envoltura. El flúor, con
nueve electrones, contiene dos en su primera envoltura y siete en la segunda. El neón, con diez
electrones, contiene dos en la primera envoltura y ocho en la segunda. Ya que el número de electrones en
la segunda envoltura aumenta, podemos deducir por qué las propiedades químicas cambian
gradualmente a medida que se va del oxígeno hacia el flúor y hacia el neón.
El sodio tiene once electrones. Dos están en la primera envoltura, pero recordemos que la segunda
envoltura sólo puede contener ocho electrones. El undécimo electrón del sodio no cabe ni en su primera
envoltura ni en la segunda. Este electrón reside en una tercera envoltura del sodio. La razón por la cual
hay un cambio drástico en las propiedades químicas cuando se va del neón al sodio, se debe a que hay
un cambio dramático en la configuración de los electrones entre estos dos elementos.
Grupo IA
V
I VIIA VIIIA
A
Litio Oxígeno Flúor Neón
Configuraciones de Electrones para Algunos Elementos
Tal como se puede apreciar en esta tabla, mientras que el sodio tiene tres envolturas de electrones y el
litio dos, lo que tienen en común es que ambos tienen un electrón en su envoltura más externa. Estas
envolturas externas de electrones (denominadas valencia de electrones) son importantes al determinar las
propiedades químicas de los elementos.
Las propiedades químicas de un elemento están determinadas por la manera en la cual sus átomos
interactúan con otros átomos. Si imaginamos la envoltura externa (valencia) de un átomo como una esfera
abarcando todo lo que está adentro, entonces es sólo la envoltura de valencia que puede interactuar con
otros átomos - tal como sólo la pintura del exterior de una casa puede 'interactuar' con el agua de la lluvia
y mojarse.
3