Page 51 - E-MODUL TERMOKIMIA RV KurMer
P. 51
E-Modul Termokimia
Berbasis Guided Discovery Learning
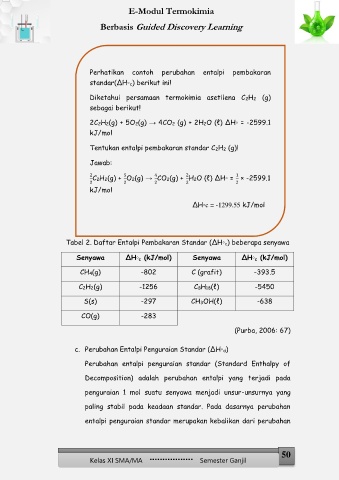
Perhatikan contoh perubahan entalpi pembakaran
standar(∆H⸰c) berikut ini!
Diketahui persamaan termokimia asetilena C2H2 (g)
sebagai berikut!
2C2H2(g) + 5O2(g) → 4CO2 (g) + 2H2O (ℓ) ∆H⸰ = -2599.1
kJ/mol
Tentukan entalpi pembakaran standar C2H2 (g)!
Jawab:
2 C2H2(g) + O2(g) → CO2(g) + H2O (ℓ) ∆H⸰ = × -2599.1
2
5
1
4
2 2 2 2 2
kJ/mol
∆H⸰c = -1299.55 kJ/mol
Tabel 2. Daftar Entalpi Pembakaran Standar (∆H⸰c) beberapa senyawa
Senyawa ∆H⸰ c (kJ/mol) Senyawa ∆H⸰ c (kJ/mol)
CH4(g) -802 C (grafit) -393.5
C2H2(g) -1256 C8H18(ℓ) -5450
S(s) -297 CH3OH(ℓ) -638
CO(g) -283
(Purba, 2006: 67)
c. Perubahan Entalpi Penguraian Standar (∆H⸰d)
Perubahan entalpi penguraian standar (Standard Enthalpy of
Decomposition) adalah perubahan entalpi yang terjadi pada
penguraian 1 mol suatu senyawa menjadi unsur-unsurnya yang
paling stabil pada keadaan standar. Pada dasarnya perubahan
entalpi penguraian standar merupakan kebalikan dari perubahan
50
Kelas XI SMA/MA Semester Ganjil