Page 25 - E-LKPD kesetimbangan kimia
P. 25
A. Hukum Kesetimbangan
Ayo Mengumpulkan Informasi
Kenalan Yuk !
Guldberg dan Waage Pada Tahun 1866
Pada tahun 1866, dua orang ahli kimia Norwegia, yaitu Cato
Maximilian Guldberg (1836-1902) dan Peter Waage (1833-1900)
mengajukan postulat berdasarkaan psejumlah pengamatan yang
mereka lakukan terhadap reaksi kesetimbangan. Pustulat ini
menyatakan bahwa “jika hasil kosentrasi zat hasil reaksi yang
dipangkatkan koefisieannya dibandingkan dengan hasil kali
kosentrasi zat pereaksi yang dipangkatkan koefisieannya, maka
akan diperoleh perbandingan yang tetap” ini lah yang dikenal
dengan aksi massa.
B. Tetapan Kesetimbngan Berdasarkan Kosentrasi (Kc)
Setiap reaksi kesetimbangan mempunyai
tetapan kesetimbangan. Nilai tetapan Info Kimia
kesetimbangan berdasarkan konsentrasi molar Pada suhu tetap harga Kc
(Kc) dihitung dari konsentrasi komponen pada selalu sama dan nilai Kc akan
keadaan setimbang. berubah jika suhu berubah. Oleh
Konsentrasi suatu zat dapat dinyatakan karena itu dalam menuliskan
dengan molaritas. Molaritas adalah banyaknya nilai Kc harus disertakan dengan
jumlah mol zat terlarut dalam tiap liter larutan. menuliskan suhu.
M= CH4 (g ) + H2O(g) ⇄ CO(g) + 3H
2(g)
Keterangan: M= konsentrasi molar, Kc = 1,78 x 10-3 pada 800°C
n= jumlah mol, V= Volume (L) Kc = 4,68 x 10-2 pada 1000°C
Kc = 5,67 pada 1500°C
Ayo Menalar
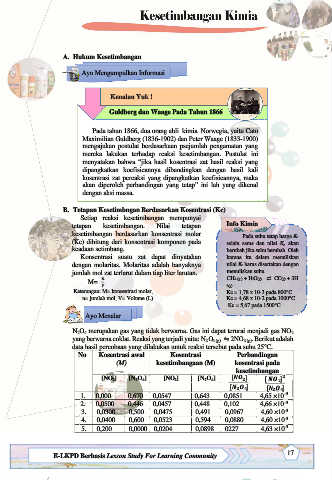
N2O4 merupakan gas yang tidak berwarna. Gas ini dapat terurai menjadi gas NO2
yang berwarna coklat. Reaksi yang terjadi yaitu: N2O4 (g) ⇋ 2NO2 (g). Berikut adalah
data hasil percobaan yang dilakukan untuk reaksi tersebut pada suhu 25°C.
No Kosentrasi awal Kosentrasi Perbandingan
(M) kesetimbangaan (M) kosentrasi pada
kesetimbangan
[NO2] [N2O4] [NO2] [N2O4] [ ] [ ]
[ ] [ ]
1. 0,000 0,670 0,0547 0,643 0,0851 4,65 ×10 -3
-3
2. 0,0500 0,446 0,0457 0,448 0,102 4,66 ×10
-3
3. 0,0300 0,500 0,0475 0,491 0,0967 4,60 ×10
-3
4. 0,0400 0,600 0,0523 0,594 0,0880 4,60 ×10
-3
5. 0,200 0,0000 0,0204 0,0898 0227 4,63 ×10
E-LKPD Berbasis Lesson Study For Learning Community 17