Page 48 - E-MODUL NANO
P. 48
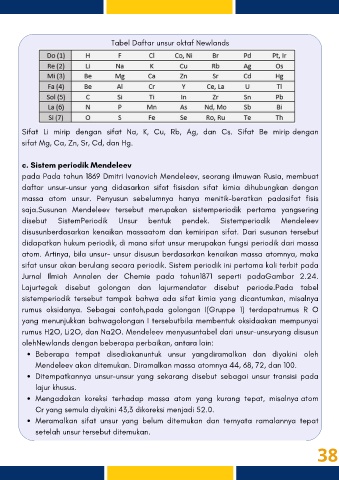
Tabel Daftar unsur oktaf Newlands
Sifat Li mirip dengan sifat Na, K, Cu, Rb, Ag, dan Cs. Sifat Be mirip dengan
sifat Mg, Ca, Zn, Sr, Cd, dan Hg.
c. Sistem periodik Mendeleev
pada Pada tahun 1869 Dmitri Ivanovich Mendeleev, seorang ilmuwan Rusia, membuat
daftar unsur-unsur yang didasarkan sifat fisisdan sifat kimia dihubungkan dengan
massa atom unsur. Penyusun sebelumnya hanya menitik-beratkan padasifat fisis
saja.Susunan Mendeleev tersebut merupakan sistemperiodik pertama yangsering
disebut SistemPeriodik Unsur bentuk pendek. Sistemperiodik Mendeleev
disusunberdasarkan kenaikan massaatom dan kemiripan sifat. Dari susunan tersebut
didapatkan hukum periodik, di mana sifat unsur merupakan fungsi periodik dari massa
atom. Artinya, bila unsur- unsur disusun berdasarkan kenaikan massa atomnya, maka
sifat unsur akan berulang secara periodik. Sistem periodik ini pertama kali terbit pada
Jurnal Ilmiah Annalen der Chemie pada tahun1871 seperti padaGambar 2.24.
Lajurtegak disebut golongan dan lajurmendatar disebut periode.Pada tabel
sistemperiodik tersebut tampak bahwa ada sifat kimia yang dicantumkan, misalnya
rumus oksidanya. Sebagai contoh,pada golongan I(Gruppe 1) terdapatrumus R O
yang menunjukkan bahwagolongan I tersebutbila membentuk oksidaakan mempunyai
rumus H2O, Li2O, dan Na2O. Mendeleev menyusuntabel dari unsur-unsuryang disusun
olehNewlands dengan beberapa perbaikan, antara lain:
Beberapa tempat disediakanuntuk unsur yangdiramalkan dan diyakini oleh
Mendeleev akan ditemukan. Diramalkan massa atomnya 44, 68, 72, dan 100.
Ditempatkannya unsur-unsur yang sekarang disebut sebagai unsur transisi pada
lajur khusus.
Mengadakan koreksi terhadap massa atom yang kurang tepat, misalnya atom
Cr yang semula diyakini 43,3 dikoreksi menjadi 52.0.
Meramalkan sifat unsur yang belum ditemukan dan ternyata ramalannya tepat
setelah unsur tersebut ditemukan.
38