Page 9 - E-Modul Oksigen dan Sulfur
P. 9
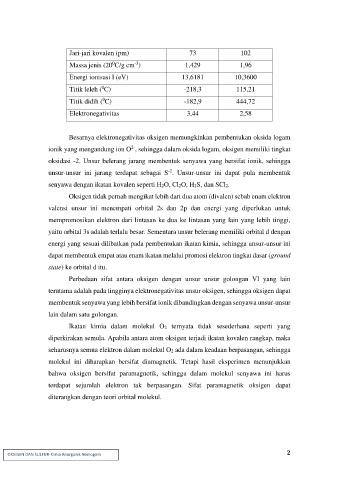
Jari-jari kovalen (pm) 73 102
-3
0
Massa jenis (20 C/g cm ) 1,429 1,96
Energi ionisasi I (eV) 13,6181 10,3600
0
Titik leleh ( C) -218,3 115,21
0
Titik didih ( C) -182,9 444,72
Elektronegativitas 3,44 2,58
Besarnya elektronegativitas oksigen memungkinkan pembentukan oksida logam
2-
ionik yang mengandung ion O , sehingga dalam oksida logam, oksigen memiliki tingkat
oksidasi -2. Unsur belerang jarang membentuk senyawa yang bersifat ionik, sehingga
-2
unsur-unsur ini jarang terdapat sebagai S . Unsur-unsur ini dapat pula membentuk
senyawa dengan ikatan kovalen seperti H2O, Cl2O, H2S, dan SCl2.
Oksigen tidak pernah mengikat lebih dari dua atom (divalen) sebab enam elektron
valensi unsur ini menempati orbital 2s dan 2p dan energi yang diperlukan untuk
mempromosikan elektron dari lintasan ke dua ke lintasan yang lain yang lebih tinggi,
yaitu orbital 3s adalah terlalu besar. Sementara unsur belerang memiliki orbital d dengan
energi yang sesuai dilibatkan pada pembentukan ikatan kimia, sehingga unsur-unsur ini
dapat membentuk empat atau enam ikatan melalui promosi elektron tingkat dasar (ground
state) ke orbital d itu.
Perbedaan sifat antara oksigen dengan unsur unsur golongan VI yang lain
terutama adalah pada tingginya elektronegativitas unsur oksigen, sehingga oksigen dapat
membentuk senyawa yang lebih bersifat ionik dibandingkan dengan senyawa unsur-unsur
lain dalam satu golongan.
Ikatan kimia dalam molekul O2 ternyata tidak sesederhana seperti yang
diperkirakan semula. Apabila antara atom oksigen terjadi ikatan kovalen rangkap, maka
seharusnya semua elektron dalam molekul O2 ada dalam keadaan berpasangan, sehingga
molekul ini diharapkan bersifat diamagnetik. Tetapi hasil eksperimen menunjukkan
bahwa oksigen bersifat paramagnetik, sehingga dalam molekul senyawa ini harus
terdapat sejumlah elektron tak berpasangan. Sifat paramagnetik oksigen dapat
diterangkan dengan teori orbital molekul.
2
OKSIGEN DAN SULFUR-Kimia Anorganik Nonlogam