Page 36 - 20-06-10_vfa_Gesamt
P. 36
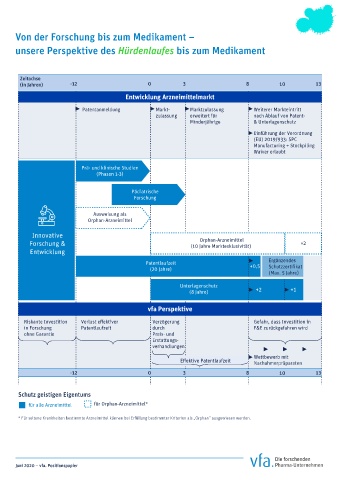
Von der Forschung bis zum Medikament –
unsere Perspektive des Hürdenlaufes bis zum Medikament
Zeitachse
(in Jahren) -12 0 3 8 10 13
Entwicklung Arzneimittelmarkt
Patentanmeldung Markt- Marktzulassung Weiterer Markteintritt
zulassung erweitert für nach Ablauf von Patent-
Minderjährige & Unterlagenschutz
Einführung der Verordnung
(EU) 2019/933: SPC
Manufacturing + Stockpiling
Waiver erlaubt
Prä- und klinische Studien
(Phasen 1-3)
Pädiatrische
Forschung
Ausweisung als
Orphan-Arzneimittel
Innovative
Orphan-Arzneimittel
Forschung & (10 Jahre Marktexklusivität) +2
Entwicklung
Patentlaufzeit Ergänzendes
(20 Jahre) +0,5
(Max. 5 Jahre)
Unterlagenschutz
(8 Jahre) +2 +1
vfa Perspektive
Riskante Investition Verzögerung Gefahr, dass Investition in
in Forschung Patentlaufzeit durch F&E zurückgefahren wird
ohne Garantie Preis- und
Erstattungs-
verhandlungen
Wettbewerb mit
Nachahmerpräparaten
-12 0 3 8 10 13
Schutz geistigen Eigentums
für alle Arzneimittel für Orphan-Arzneimittel*
* Für seltene Krankheiten bestimmte Arzneimittel können bei Erfüllung bestimmter Kriterien als „Orphan“ ausgewiesen werden.
Juni 2020 – vfa. Positionspapier