Page 55 - MODUL TERMOKIMIA (FASE F) BERBASIS PBL
P. 55
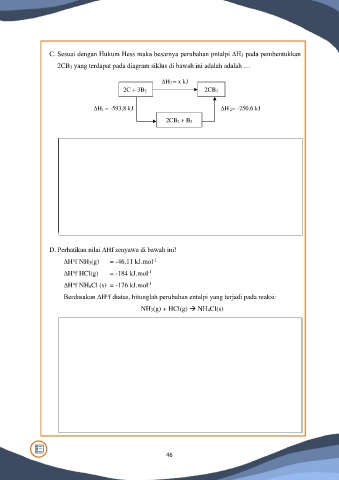
C. Sesuai dengan Hukum Hess maka besarnya perubahan pntalpi ∆H3 pada pembentukkan
2CB3 yang terdapat pada diagram siklus di bawah ini adalah adalah …
∆H3 = x kJ
2C + 3B2 2CB3
∆H1 = -593,8 kJ ∆H 2= -250,6 kJ
2CB2 + B2
D. Perhatikan nilai ∆Hf senyawa di bawah ini!
o
-1
∆H f NH3(g) = -46,11 kJ.mol
-1
o
∆H f HCl(g) = -184 kJ.mol
-1
o
∆H f NH4Cl (s) = -176 kJ.mol
Berdasakan ∆H f diatas, hitunglah perubahan entalpi yang terjadi pada reaksi:
o
NH3(g) + HCl(g) → NH4Cl(s)
46