Page 12 - KI - quimica
P. 12
Química 2° Secundaria
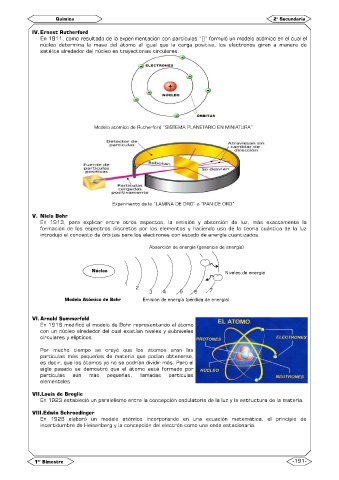
IV. Ernest Rutherford
núcleo determina la masa del átomo al igual que la carga positiva, los electrones giran a manera de
satélite alrededor del núcleo en trayectorias circulares.
Modelo atómico de Rutherford “SISTEMA PLANETARIO EN MINIATURA”
Experimento de la “LAMINA DE ORO” o “PAN DE ORO”
V. Niels Bohr
En 1913, para explicar entre otros aspectos, la emisión y absorción de luz, más exactamente la
formación de los espectros discretos por los elementos y haciendo uso de la teoría cuántica de la luz
introdujo el concepto de órbitas para los electrones con estado de energía cuantizados.
Absorción de energía (ganancia de energía)
-
Núcleo Niveles de energía
-
1
2
3 4 5 6 7
Modelo Atómico de Bohr Emisión de energía (pérdida de energía)
VI. Arnold Sommerfeld
En 1916 modificó el modelo de Bohr representando al átomo
con un núcleo alrededor del cual existían niveles y subniveles
circulares y elípticos.
Por mucho tiempo se creyó que los átomos eran las
partículas más pequeñas de materia que podían obtenerse,
es decir, que los átomos ya no se podrían dividir más. Pero el
siglo pasado se demostró que el átomo está formado por
partículas aún más pequeñas, llamadas partículas
elementales.
VII.Louis de Broglie
En 1923 estableció un paralelismo entre la concepción ondulatoria de la luz y la estructura de la materia.
VIII.Edwin Schroedinger
En 1926 elaboró un modelo atómico incorporando en una ecuación matemática, el principio de
incertidumbre de Heisenberg y la concepción del electrón como una onda estacionaria.
er
1 Bimestre -191-