Page 39 - [Revisi Uji Coba Skala Kecil] E-MODUL PRAKTIKUM TERMOKIMIA_Neat
P. 39
perubahan entalpi pembentukan (ΔH°) standar untuk setiap senyawa,
f
maka nilai perubahan entalpinya dapat dihitung sebagai berikut.
ΔHreaksi = ΣΔH° produk - ΣΔH° reaktan
f
f
ΔHreaksi = (c x ΔH° C + d x ΔH° D) - (a x ΔH° A + b x ΔH° B)
f
f
f
f
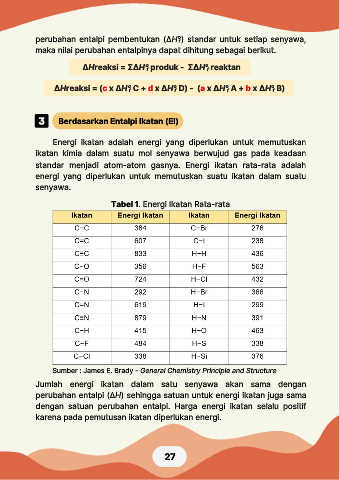
Berdasarkan Entalpi Ikatan (EI)
Energi ikatan adalah energi yang diperlukan untuk memutuskan
ikatan kimia dalam suatu mol senyawa berwujud gas pada keadaan
standar menjadi atom-atom gasnya. Energi ikatan rata-rata adalah
energi yang diperlukan untuk memutuskan suatu ikatan dalam suatu
senyawa.
Tabel 1. Energi Ikatan Rata-rata
Sumber : James E. Brady - General Chemistry Principle and Structure
Jumlah energi ikatan dalam satu senyawa akan sama dengan
perubahan entalpi (ΔH) sehingga satuan untuk energi ikatan juga sama
dengan satuan perubahan entalpi. Harga energi ikatan selalu positif
karena pada pemutusan ikatan diperlukan energi.
27