Page 15 - MODUL TREMODINAMIKAok
P. 15
Pada proses isokhorik, kalor yang diberikan kepada sistem hanya digunakan untuk menaikkan
energi di dalamnya. Menurut Hukum Gay Lussac proses isokhorik pada gas dapat dinyatakan dengan
persamaan :
= konstan atau
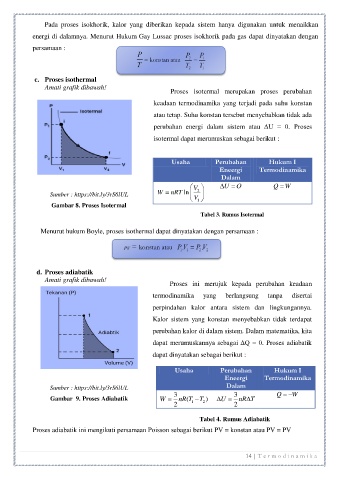
c. Proses isothermal
Amati grafik dibawah! Proses isotermal merupakan proses perubahan
keadaan termodinamika yang terjadi pada suhu konstan
atau tetap. Suhu konstan tersebut menyebabkan tidak ada
perubahan energi dalam sistem atau ΔU = 0. Proses
isotermal dapat merumuskan sebagai berikut :
Usaha Perubahan Hukum I
Eneergi Termodinamika
Dalam
V 2 U O Q W
Sumber : https://bit.ly/3rS6lUL W nRT ln
V 1
Gambar 8. Proses Isotermal
Tabel 3. Rumus Isotermal
Menurut hukum Boyle, proses isothermal dapat dinyatakan dengan persamaan :
= konstan atau
d. Proses adiabatik
Amati grafik dibawah!
Proses ini merujuk kepada perubahan keadaan
termodinamika yang berlangsung tanpa disertai
perpindahan kalor antara sistem dan lingkungannya.
Kalor sistem yang konstan menyebabkan tidak terdapat
perubahan kalor di dalam sistem. Dalam matematika, kita
dapat merumuskannya sebagai ΔQ = 0. Proses adiabatik
dapat dinyatakan sebagai berikut :
Usaha Perubahan Hukum I
Eneergi Termodinamika
Sumber : https://bit.ly/3rS6lUL Dalam
Gambar 9. Proses Adiabatik W 3 nR (T 1 T 2 ) U 3 nR T Q W
2 2
Tabel 4. Rumus Adiabatik
Proses adiabatik ini mengikuti persamaan Poisson sebagai berikut PV = konstan atau PV = PV
14 | T e r m o d i n a m i k a