Page 9 - ikatan kimia
P. 9
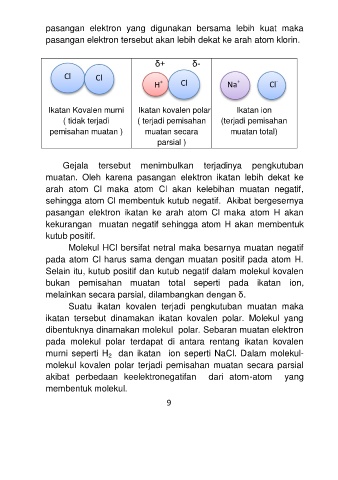
pasangan elektron yang digunakan bersama lebih kuat maka
pasangan elektron tersebut akan lebih dekat ke arah atom klorin.
δ+ δ-
Cl Cl
+
-
H + Cl Na Cl
+
Ikatan Kovalen murni Ikatan kovalen polar Ikatan ion
( tidak terjadi ( terjadi pemisahan (terjadi pemisahan
pemisahan muatan ) muatan secara muatan total)
parsial )
Gejala tersebut menimbulkan terjadinya pengkutuban
muatan. Oleh karena pasangan elektron ikatan lebih dekat ke
arah atom Cl maka atom Cl akan kelebihan muatan negatif,
sehingga atom Cl membentuk kutub negatif. Akibat bergesernya
pasangan elektron ikatan ke arah atom Cl maka atom H akan
kekurangan muatan negatif sehingga atom H akan membentuk
kutub positif.
Molekul HCl bersifat netral maka besarnya muatan negatif
pada atom Cl harus sama dengan muatan positif pada atom H.
Selain itu, kutub positif dan kutub negatif dalam molekul kovalen
bukan pemisahan muatan total seperti pada ikatan ion,
melainkan secara parsial, dilambangkan dengan δ.
Suatu ikatan kovalen terjadi pengkutuban muatan maka
ikatan tersebut dinamakan ikatan kovalen polar. Molekul yang
dibentuknya dinamakan molekul polar. Sebaran muatan elektron
pada molekul polar terdapat di antara rentang ikatan kovalen
murni seperti H 2 dan ikatan ion seperti NaCl. Dalam molekul-
molekul kovalen polar terjadi pemisahan muatan secara parsial
akibat perbedaan keelektronegatifan dari atom-atom yang
membentuk molekul.
9