Page 3 - bentuk molekul
P. 3
materi78.co.nr KIM 1
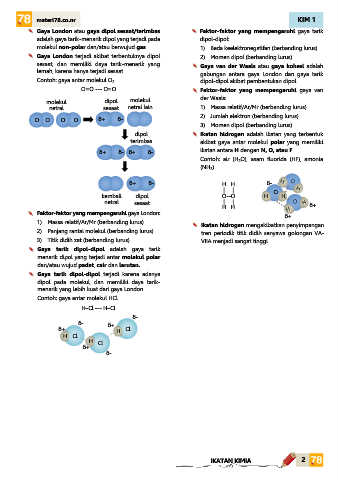
Gaya London atau gaya dipol sesaat/terimbas Faktor-faktor yang mempengaruhi gaya tarik
adalah gaya tarik-menarik dipol yang terjadi pada dipol-dipol:
molekul non-polar dan/atau berwujud gas. 1) Beda keelektronegatifan (berbanding lurus)
Gaya London terjadi akibat terbentuknya dipol 2) Momen dipol (berbanding lurus)
sesaat, dan memiliki daya tarik-menarik yang Gaya van der Waals atau gaya kohesi adalah
lemah, karena hanya terjadi sesaat. gabungan antara gaya London dan gaya tarik
Contoh: gaya antar molekul O 2. dipol-dipol akibat pembentukan dipol.
O=O --- O=O Faktor-faktor yang mempengaruhi gaya van
molekul dipol molekul der Waals:
netral sesaat netral lain 1) Massa relatif/Ar/Mr (berbanding lurus)
O O O O δ+ δ- 2) Jumlah elektron (berbanding lurus)
3) Momen dipol (berbanding lurus)
dipol Ikatan hidrogen adalah ikatan yang terbentuk
terimbas akibat gaya antar molekul polar yang memiliki
δ+ δ- δ+ δ- ikatan antara H dengan N, O, atau F.
Contoh: air (H2O), asam fluorida (HF), amonia
(NH3).
δ+ δ- H H δ-
| | O
kembali dipol O--O H H
netral sesaat | |
H H δ+
Faktor-faktor yang mempengaruhi gaya London: δ+
1) Massa relatif/Ar/Mr (berbanding lurus) Ikatan hidrogen mengakibatkan penyimpangan
2) Panjang rantai molekul (berbanding lurus) tren periodik titik didih senyawa golongan VA-
3) Titik didih zat (berbanding lurus) VIIA menjadi sangat tinggi.
Gaya tarik dipol-dipol adalah gaya tarik
menarik dipol yang terjadi antar molekul polar
dan/atau wujud padat, cair dan larutan.
Gaya tarik dipol-dipol terjadi karena adanya
dipol pada molekul, dan memiliki daya tarik-
menarik yang lebih kuat dari gaya London.
Contoh: gaya antar molekul HCl.
H–Cl --- H–Cl
δ-
δ- δ+
δ+ H Cl
H Cl
H Cl
δ+
δ-
IKATAN KIMIA 2