Page 59 - E-MODUL IKATAN KIMIA-KELAS 10._Neat
P. 59
IKATAN KIMIA
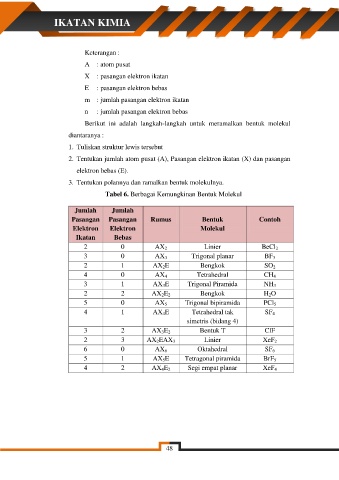
Keterangan :
A : atom pusat
X : pasangan elektron ikatan
E : pasangan elektron bebas
m : jumlah pasangan elektron ikatan
n : jumlah pasangan elektron bebas
Berikut ini adalah langkah-langkah untuk meramalkan bentuk molekul
diantaranya :
1. Tuliskan struktur lewis tersebut
2. Tentukan jumlah atom pusat (A), Pasangan elektron ikatan (X) dan pasangan
elektron bebas (E).
3. Tentukan polannya dan ramalkan bentuk molekulnya.
Tabel 6. Berbagai Kemungkinan Bentuk Molekul
Jumlah Jumlah
Pasangan Pasangan Rumus Bentuk Contoh
Elektron Elektron Molekul
Ikatan Bebas
2 0 AX 2 Linier BeCl 2
3 0 AX 3 Trigonal planar BF 3
2 1 AX 2E Bengkok SO 2
4 0 AX 4 Tetrahedral CH 4
3 1 AX 3E Trigonal Piramida NH 3
2 2 AX 2E 2 Bengkok H 2O
5 0 AX 5 Trigonal bipiramida PCl 5
4 1 AX 4E Tetrahedral tak SF 4
simetris (bidang 4)
3 2 AX 3E 2 Bentuk T ClF
2 3 AX 2EAX 3 Linier XeF 2
6 0 AX 6 Oktahedral SF 6
5 1 AX 5E Tetragonal piramida BrF 5
4 2 AX 4E 2 Segi empat planar XeF 4
48