Page 21 - E-MODUL _DESMA LINDA _A1C119075
P. 21
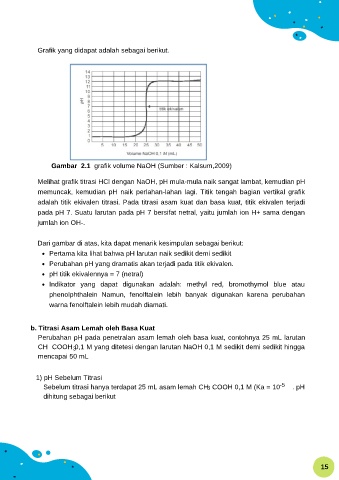
Grafik yang didapat adalah sebagai berikut.
Gambar 2.1 grafik volume NaOH (Sumber : Kalsum,2009)
Melihat grafik titrasi HCl dengan NaOH, pH mula-mula naik sangat lambat, kemudian pH
memuncak, kemudian pH naik perlahan-lahan lagi. Titik tengah bagian vertikal grafik
adalah titik ekivalen titrasi. Pada titrasi asam kuat dan basa kuat, titik ekivalen terjadi
pada pH 7. Suatu larutan pada pH 7 bersifat netral, yaitu jumlah ion H+ sama dengan
jumlah ion OH-.
Dari gambar di atas, kita dapat menarik kesimpulan sebagai berikut:
Pertama kita lihat bahwa pH larutan naik sedikit demi sedikit
Perubahan pH yang dramatis akan terjadi pada titik ekivalen.
pH titik ekivalennya = 7 (netral)
Indikator yang dapat digunakan adalah: methyl red, bromothymol blue atau
phenolphthalein Namun, fenolftalein lebih banyak digunakan karena perubahan
warna fenolftalein lebih mudah diamati.
b. Titrasi Asam Lemah oleh Basa Kuat
Perubahan pH pada penetralan asam lemah oleh basa kuat, contohnya 25 mL larutan
CH COOH 0,1 M yang ditetesi dengan larutan NaOH 0,1 M sedikit demi sedikit hingga
3
mencapai 50 mL
1) pH Sebelum Titrasi
-5
Sebelum titrasi hanya terdapat 25 mL asam lemah CH COOH 0,1 M (Ka = 10 . pH
3
dihitung sebagai berikut
15