Page 6 - g lyk
P. 6
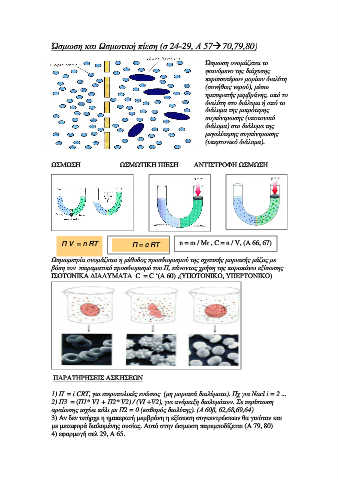
Ώσµωση και Ωσµωτική πίεση (σ 24-29, Α 57 70,79,80)
Ώσµωση ονοµάζεται το
φαινόµενο της διάχυσης
περισσοτέρων µορίων διαλύτη
(συνήθως νερού), µέσω
ηµιπερατής µεµβράνης, από το
διαλύτη στο διάλυµα ή από το
διάλυµα της µικρότερης
συγκέντρωσης (υποτονικό
διάλυµα) στο διάλυµα της
µεγαλύτερης συγκέντρωσης
(υπερτονικό διάλυµα).
ΩΣΜΩΣΗ ΩΣΜΩΤΙΚΗ ΠΙΕΣΗ ΑΝΤΙΣΤΡΟΦΗ ΩΣΜΩΣΗ
Π V = n RT Π = c RT n = m / Mr , C = n / V, (Α 66, 67)
Ωσµωµετρία ονοµάζεται η µέθοδος προσδιορισµού της σχετικής µοριακής µάζας µε
βάση τον πειραµατικό προσδιορισµό του Π, κάνοντας χρήση της παραπάνω εξίσωσης
ΙΣΟΤΟΝΙΚΑ ∆ΙΑΛΥΜΑΤΑ C = C ‘(Α 60) ,(ΥΠΟΤΟΝΙΚΟ, ΥΠΕΡΤΟΝΙΚΟ)
ΠΑΡΑΤΗΡΗΣΕΙΣ ΑΣΚΗΣΕΩΝ
1) Π = i CRT, για ετεροπολικές ενώσεις (µη µοριακά διαλύµατα). Πχ για Nacl i = 2 ...
2) Π3 = (Π1* V1 + Π2* V2) / (VI +V2), για ανάµειξη διαλυµάτων. Σε περίπτωση
αραίωσης ισχύει πάλι µε Π2 = 0 (καθαρός διαλύτης). (Α 60β, 62,68,69,64)
3) Αν δεν υπήρχε η ηµιπερατή µεµβράνη η εξίσωση συγκεντρώσεων θα γινόταν και
µε µεταφορά διαλυµένης ουσίας. Αυτό στην ώσµωση παρεµποδίζεται (Α 79, 80)
4) εφαρµογή σελ 29, Α 65.