Page 16 - E-MODUL HIDROLISIS GARAM DAN LARUTAN PENYANGGA
P. 16
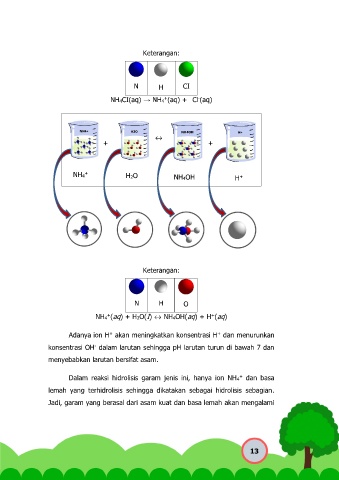
Keterangan:
N H CI
-
NH4CI(aq) → NH4 (aq) + Cl (aq)
+
↔
+ +
NH4 H2O NH4OH H
+
+
Keterangan:
N H O
+
NH4 (aq) + H2O(I) ↔ NH4OH(aq) + H (aq)
+
Adanya ion H akan meningkatkan konsentrasi H dan menurunkan
+
+
konsentrasi OH dalam larutan sehingga pH larutan turun di bawah 7 dan
-
menyebabkan larutan bersifat asam.
Dalam reaksi hidrolisis garam jenis ini, hanya ion NH4 dan basa
+
lemah yang terhidrolisis sehingga dikatakan sebagai hidrolisis sebagian.
Jadi, garam yang berasal dari asam kuat dan basa lemah akan mengalami
13 13