Page 35 - E-MODUL ASAM BASA FIX
P. 35
XI
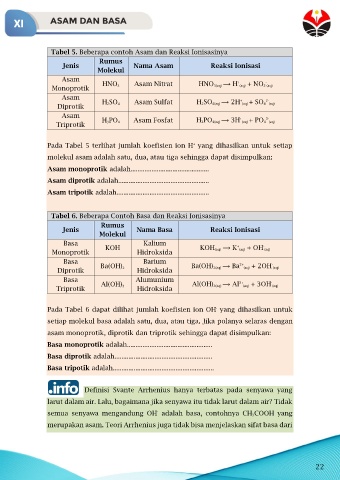
Tabel 5. Beberapa contoh Asam dan Reaksi Ionisasinya
Rumus
Jenis Nama Asam Reaksi Ionisasi
Molekul
Asam + -
Monoprotik HNO 3 Asam Nitrat HNO 3(aq) ⟶ H (aq) + NO 3 (aq)
Asam + 2-
Diprotik H 2SO 4 Asam Sulfat H 2SO 4(aq) ⟶ 2H (aq) + SO 4 (aq)
Asam + 3-
Triprotik H 3PO 4 Asam Fosfat H 3PO 4(aq) ⟶ 3H (aq) + PO 4 (aq)
Pada Tabel 5 terlihat jumlah koefisien ion H yang dihasilkan untuk setiap
+
molekul asam adalah satu, dua, atau tiga sehingga dapat disimpulkan:
Asam monoprotik adalah.............................................
Asam diprotik adalah....................................................
Asam tripotik adalah.....................................................
Tabel 6. Beberapa Contoh Basa dan Reaksi Ionisasinya
Rumus
Jenis Nama Basa Reaksi Ionisasi
Molekul
Basa Kalium KOH (aq) ⟶ K (aq) + OH (aq)
-
+
Monoprotik KOH Hidroksida
Basa Barium 2+ -
Diprotik Ba(OH) 2 Hidroksida Ba(OH) 2(aq) ⟶ Ba (aq) + 2OH (aq)
Basa Alumunium 3+ -
Triprotik Al(OH) 3 Hidroksida Al(OH) 3(aq) ⟶ Al (aq) + 3OH (aq)
Pada Tabel 6 dapat dilihat jumlah koefisien ion OH yang dihasilkan untuk
-
setiap molekul basa adalah satu, dua, atau tiga. Jika polanya selaras dengan
asam monoprotik, diprotik dan triprotik sehingga dapat disimpulkan:
Basa monoprotik adalah.................................................
Basa diprotik adalah........................................................
Basa tripotik adalah..........................................................
Definisi Svante Arrhenius hanya terbatas pada senyawa yang
larut dalam air. Lalu, bagaimana jika senyawa itu tidak larut dalam air? Tidak
semua senyawa mengandung OH adalah basa, contohnya CH 3COOH yang
-
merupakan asam. Teori Arrhenius juga tidak bisa menjelaskan sifat basa dari
22