Page 30 - E-Modul Larutan Elektrolit dan Non Elektrolit
P. 30
membentuk larutan elektrolit kuat dan sebagian yang lain membentuk
elektrolit lemah. Adapun senyawa kovalen molekular polar dalam air
membentuk larutan nonelektrolit.
Oleh karena itu, penggolongan larutan didasarkan pada sifat disosiasinya
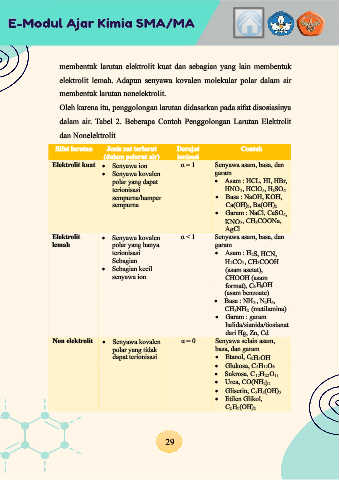
dalam air. Tabel 2. Beberapa Contoh Penggolongan Larutan Elektrolit
dan Nonelektrolit
Sifat larutan Jenis zat terlarut Derajat Contoh
(dalam pelarut air) ionisasi
Elektrolit kuat • Senyawa ion α = 1 Senyawa asam, basa, dan
• Senyawa kovalen garam
polar yang dapat • Asam : HCL, HI, HBr,
terionisasi HNO3, HClO4, H2SO4
sempurna/hamper • Basa : NaOH, KOH,
sempurna Ca(OH)2, Ba(OH)2
• Garam : NaCl, CaSO4,
KNO3, CH3COONa,
AgCl
Elektrolit • Senyawa kovalen α < 1 Senyawa asam, basa, dan
lemah polar yang hanya garam
terionisasi • Asam : H2S, HCN,
Sebagian H2CO3, CH3COOH
• Sebagian kecil (asam asetat),
senyawa ion CHOOH (asam
format), C6H6OH
(asam benzoate)
• Basa : NH3, N2H4,
CH3NH2 (metilamina)
• Garam : garam
halida/sianida/tiosianat
dari Hg, Zn, Cd
Non elektrolit • Senyawa kovalen α = 0 Senyawa selain asam,
polar yang tidak basa, dan garam
dapat terionisasi • Etanol, C2H5OH
• Glukosa, C6H12O6
• Sukrosa, C12H22O11
• Urea, CO(NH2)2
• Gliserin, C3H5(OH)3
• Etilen Glikol,
C2H4(OH)2
29