Page 63 - Modul Ikatan
P. 63
Dengan hadirnya ikatan hidrogen dalam sautau senyawa menimbulkan pengaruh terhadap
sifat-sifat fisik senyawa seperti ditunjukkan oleh senyawa hidrida nonlogam berikut
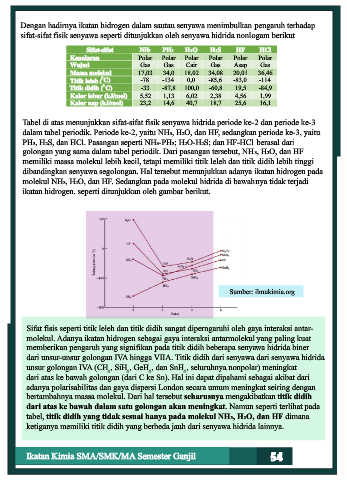
Sifat-sifat NH3 PH3 H2O H2S HF HCl
Kepolaran Polar Polar Polar Polar Polar Polar
Wujud Gas Gas Cair Gas Asap Gas
Massa molekul 17,03 34,0 18,02 34,08 20,01 36,46
0
Titik leleh ( C) -78 -134 0,0 -85,6 -83,0 -114
0
Titik didih ( C) -33 -87,8 100,0 -60,8 19,5 -84,9
Kalor lebur (kJ/mol) 5,52 1,13 6,02 2,38 4,56 1,99
Kalor uap (kJ/mol) 23,2 14,6 40,7 18,7 25,6 16,1
Tabel di atas menunjukkan sifat-sifat fisik senyawa hidrida periode ke-2 dan periode ke-3
dalam tabel periodik. Periode ke-2, yaitu NH3, H2O, dan HF, sedangkan periode ke-3, yaitu
PH3, H2S, dan HCl. Pasangan seperti NH3-PH3; H2O-H2S; dan HF-HCl berasal dari
golongan yang sama dalam tabel periodik. Dari pasangan tersebut, NH3, H2O, dan HF
memiliki massa molekul lebih kecil, tetapi memiliki titik leleh dan titik didih lebih tinggi
dibandingkan senyawa segolongan. Hal tersebut menunjukkan adanya ikatan hidrogen pada
molekul NH3, H2O, dan HF. Sedangkan pada molekul hidrida di bawahnya tidak terjadi
ikatan hidrogen. seperti ditunjukkan oleh gambar berikut.
Sumber: ilmukimia.org
Sifat fisis seperti titik leleh dan titik didih sangat diperngaruhi oleh gaya interaksi antar-
molekul. Adanya ikatan hidrogen sebagai gaya interaksi antarmolekul yang paling kuat
memberikan pengaruh yang signifikan pada titik didih beberapa senyawa hidrida biner
dari unsur-unsur golongan IVA hingga VIIA. Titik didih dari senyawa dari senyawa hidrida
unsur golongan IVA (CH , SiH , GeH , dan SnH , seluruhnya nonpolar) meningkat
4
4
4
4
dari atas ke bawah golongan (dari C ke Sn). Hal ini dapat dipahami sebagai akibat dari
adanya polarisabilitas dan gaya dispersi London secara umum meningkat seiring dengan
bertambahnya massa molekul. Dari hal tersebut seharusnya mengakibatkan titik didih
dari atas ke bawah dalam satu golongan akan meningkat. Namun seperti terlihat pada
tabel, titik didih yang tidak sesuai hanya pada molekul NH3, H2O, dan HF dimana
ketiganya memiliki titik didih yang berbeda jauh dari senyawa hidrida lainnya.
Ikatan Kimia SMA/SMK/MA Semester Ganjil 54