Page 47 - KIMIA SMA KELAS XII BERBASIS PjBl
P. 47
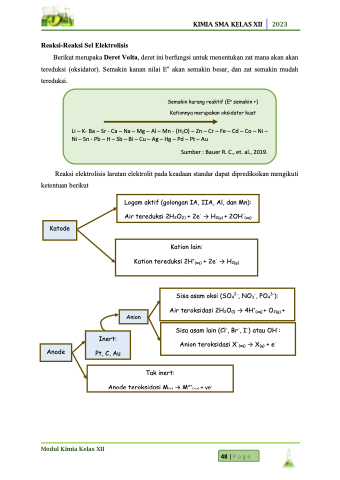
Reaksi-Reaksi Sel Elektrolisis
Berikut merupaka Deret Volta, deret ini berfungsi untuk menentukan zat mana akan akan
tereduksi (oksidator). Semakin kanan nilai Eo akan semakin besar, dan zat semakin mudah tereduksi.
Semakin kurang reaktif (Eo semakin +) Kationnya merupakan oksidator kuat
Li – K- Ba – Sr - Ca – Na – Mg – Al – Mn - (H2O) – Zn – Cr – Fe – Cd – Co – Ni – Ni – Sn - Pb – H – Sb – Bi – Cu – Ag – Hg – Pd – Pt – Au
Sumber : Bauer R. C., et. al., 2019.
Reaksi elektrolisis larutan elektrolit pada keadaan standar dapat diprediksikan mengikuti ketentuan berikut
KIMIA SMA KELAS XII 2023
Logam aktif (golongan IA, IIA, Al, dan Mn): Air tereduksi 2H2O(l) + 2e- → H2(g) + 2OH-(aq)
Katode
Kation lain:
Kation tereduksi 2H+(aq) + 2e- → H2(g) x+ -
L (aq)+xe→L(s)
Sisa asam oksi (SO42-, NO3-, PO43-):
Air teroksidasi 2H2O(l) → 4H+(aq) + O2(g) + 4e-
Sisa asam lain (Cl-, Br-, I-) atau OH-: Anion teroksidasi X-(aq) → X(g) + e-
Anion
Inert: Pt, C, Au
Anode
4OH-(aq) → 2H2O(l) + O2(g) + 4e-
Tak inert:
Anode teroksidasi M(s) → Mx+(aq) + ye-
Modul Kimia Kelas XII
48 | P a g e