Page 36 - E-Modul Termokimia Berbasis PBL
P. 36
Membimbing Penyelidikan Individu/Kelompok
Sebelumnya kita sudah mempelajari mengenai interaksi sistem dan
lingkungan. berdasarkan perpindahan kalor yang terjadi pada sistem
dan lingkungan, reaksi termokimia dibedakan menjadi reaksi
eksoterm dan reaksi endoterm.
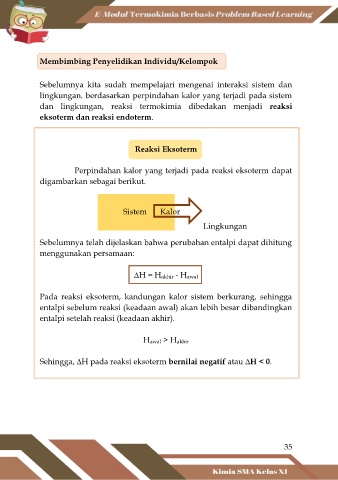
Reaksi Eksoterm
Perpindahan kalor yang terjadi pada reaksi eksoterm dapat
digambarkan sebagai berikut.
Sistem Kalor
Lingkungan
Sebelumnya telah dijelaskan bahwa perubahan entalpi dapat dihitung
menggunakan persamaan:
∆H = H akhir - H awal
Pada reaksi eksoterm, kandungan kalor sistem berkurang, sehingga
entalpi sebelum reaksi (keadaan awal) akan lebih besar dibandingkan
entalpi setelah reaksi (keadaan akhir).
H awal > H akhir
Sehingga, ∆H pada reaksi eksoterm bernilai negatif atau ∆H < 0.
35