Page 58 - E-Modul_Asam Basa_Nur Fadillah_Unimed
P. 58
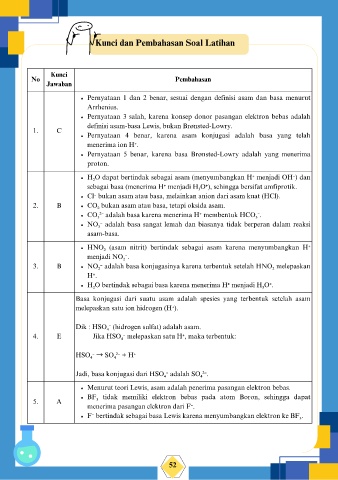
Kunci dan Pembahasan Soal Latihan
Kunci
No Pembahasan
Jawaban
Pernyataan 1 dan 2 benar, sesuai dengan definisi asam dan basa menurut
Arrhenius.
Pernyataan 3 salah, karena konsep donor pasangan elektron bebas adalah
definisi asam-basa Lewis, bukan Brønsted-Lowry.
1. C
Pernyataan 4 benar, karena asam konjugasi adalah basa yang telah
menerima ion H⁺.
Pernyataan 5 benar, karena basa Brønsted-Lowry adalah yang menerima
proton.
H₂O dapat bertindak sebagai asam (menyumbangkan H⁺ menjadi OH⁻) dan
sebagai basa (menerima H⁺ menjadi H₃O⁺), sehingga bersifat amfiprotik.
Cl⁻ bukan asam atau basa, melainkan anion dari asam kuat (HCl).
2. B CO₂ bukan asam atau basa, tetapi oksida asam.
CO₃²⁻ adalah basa karena menerima H⁺ membentuk HCO₃⁻.
NO₃⁻ adalah basa sangat lemah dan biasanya tidak berperan dalam reaksi
asam-basa.
HNO₂ (asam nitrit) bertindak sebagai asam karena menyumbangkan H⁺
menjadi NO₂⁻.
3. B NO₂⁻ adalah basa konjugasinya karena terbentuk setelah HNO₂ melepaskan
H⁺.
H₂O bertindak sebagai basa karena menerima H⁺ menjadi H₃O⁺.
Basa konjugasi dari suatu asam adalah spesies yang terbentuk setelah asam
melepaskan satu ion hidrogen (H⁺).
Dik : HSO₄⁻ (hidrogen sulfat) adalah asam.
4. E Jika HSO₄⁻ melepaskan satu H⁺, maka terbentuk:
HSO₄⁻ → SO₄²⁻ + H⁺
Jadi, basa konjugasi dari HSO₄⁻ adalah SO₄²⁻.
Menurut teori Lewis, asam adalah penerima pasangan elektron bebas.
BF₃ tidak memiliki elektron bebas pada atom Boron, sehingga dapat
5. A
menerima pasangan elektron dari F⁻.
F⁻ bertindak sebagai basa Lewis karena menyumbangkan elektron ke BF₃.
52